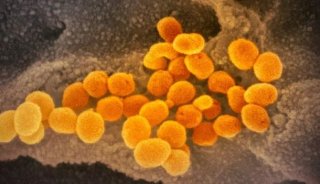
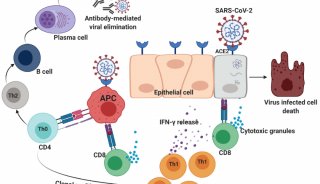
作为不断创新的生物科技领跑者,Fluidigm公司(纳斯达克:FLDM)长期致力于通过全方位的健康洞察力来改善人们的生活。近日,Fluidigm公司宣布,旗下所开发的基于唾液免提取核酸检测方法的Fluidigm® Advanta™ Dx SARS-CoV-2 RT-PCR检测试剂盒已获得CE-IVD 认证。CE-IVD认证的获得表明该试剂盒符合欧盟体外诊断指令。
Fluidigm® Advanta™ Dx SARS-CoV-2 RT-PCR检测试剂盒无需采用侵入性方法采集鼻咽拭子。Fluidigm公司向FDA提交的临床研究显示,Advanta™ Dx SARS-CoV-2 RT-PCR检测试剂盒的唾液免提取检测结果与授权检测的鼻咽样本检测结果之间100%一致。 越来越多的同行评议研究证实,基于唾液样本的COVID-19检测方法的准确性可与基于鼻咽样本的检测方法准确性相媲美。《美国医学会内科杂志》(JAMA Internal Medicine)于2021年1月发表的一篇系统综述和Meta分析指出,基于唾液样本的检测方法具有与基于鼻咽样本检测方法类似的敏感性和特异性,是侵入性鼻咽样本采集检测方法的一个有吸引力的替代选择。 “自我们的唾液PCR检测方法在美国推出之后,人们对我们的技术展现出越来越多的兴趣。根据第三方和公司的估算,2021年欧洲区域COVID-19检测的总目标市场是50亿至70亿美元,我们很高兴能有机会将该检测方法在欧洲区域全面推广,成为进入该区域市场的首批唾液免提取检测方法之一。”Fluidigm总裁兼首席执行官Chris Linthwaite谈道。“欧洲区域目前每四天报告新增感染100万例,自大流行开始以来,已有2700多万例病例。” “在疫情的初发阶段,我们通过自有实验室COVID-19检测为欧洲市场提供支持。现在我们很高兴能有机会通过我们的直销及代理商为欧洲市场提供Fluidigm CE-IVD商业试剂盒,包括进行非医疗机构指定的潜在筛查应用。” “在此全球健康危机的关键时刻,我们正在向欧洲提供这种急需的非侵入性检测解决方案。我们预计,支持旅行、工作场所和其他环境测试的私人实验室将会对该技术产生浓厚兴趣,我们相信,Fluidigm的高通量技术和免提取特性将是吸引欧洲市场的主要驱动力之一。此外,我们的检测方法具有集成的测试平台和可靠的供应链,实验室可以轻松将其与常用的自动化平台相结合。” Fluidigm一直持续对此Advanta Dx 新冠病毒检测试剂盒进行生信分析以确定其检测的有效性。截至目前为止,已知的病毒突变尚未对该检测的引物和探针的靶向病毒基因组区域产生有意义的影响。