安捷伦Seahorse发布最新细胞代谢与药物靶点电子书
最新安捷伦Seahorse药物靶点电子书来啦!通过细胞代谢揭示新的药物靶点

细胞代谢——药物发现的新途径
药物靶点鉴定是发现和开发安全有效疗法的关键步骤。能量代谢通常被认为仅提供“管家”功能,但是现在正成为影响许多细胞功能的关键因素。代谢功能障碍也与越来越多的不同疾病状态相关。因此,研究调控能量代谢的基因、蛋白质和通路是一种有希望用于开发各种疾病新型治疗策略的新途径,我们据此为您准备了最新一期的药物靶点电子书。
本期参考电子书提供了影响以下关键疾病领域的代谢靶标示例:
癌症
免疫肿瘤学/免疫疗法
神经退行性疾病
糖尿病、心血管病及获得性代谢紊乱
扫描二维码或点击按钮,即可下载全文

下载电子书

能量代谢的改变现已被视为癌症的标志[1]。因此,对影响代谢通路的靶标的鉴定为可能有效的癌症疗法提供了关键见解。
研究人员在确定癌细胞中的药物靶点方面已经取得了重大进展,其中着重强调了代谢中间体是癌症药物发现中的关键靶标。
靶标:致癌基因、相关分子靶点和代谢通路
致癌基因负责将癌细胞能量代谢改编为倾向于生物质积累和糖酵解能量产生,而非非增殖性细胞中发生的线粒体能量产生。致癌基因通路中间体(包括基因、蛋白质和酶)代表了有前景的癌症治疗靶标。
表征图:同时测量氧化磷酸化和糖酵解

摘自 Dar, S., et al. Bioenergetic Adaptations in Chemoresistant Ovarian Cancer Cells. Sci Rep. 2017. 7 (1):8760。
靶标:营养物质输送和利用
为支持生物质积累,癌细胞增加了对肿瘤微环境中的底物和营养物的摄取。潜在的代谢靶标主要能够抑制或激活与底物和营养物质输送或利用相关的基因、蛋白质和通路。
确定癌细胞模型的底物依赖性

表 1 列出了几种有癌症治疗前景的代谢靶标。这些代谢靶标的开发阶段和有效性范围从临床前延伸到临床以及临床后,并代表了药物靶点鉴定和验证的机会区域。
表 1. 有癌症治疗前景的代谢靶标
癌症研究中代谢合成致死性的治疗靶标
“癌细胞的快速增殖仅仅需要更多能量、ATP 和大分子。因此,细胞必须重新连接它们的代谢网络以满足这些需求。这为在癌症治疗中靶向肿瘤代谢提供了许多可能的机会。”
Yuting Sun 博士
安德森癌症中心
高级研究科学家

调节免疫细胞的活性来治疗癌症或自身免疫性疾病等多种疾病,是药物发现的研究热点之一。代谢重编程在免疫细胞的即时反应以及调控细胞命运中具有关键作用。不同的免疫细胞类型具有独特的代谢需求,以支持能量和生物合成的需求。
肿瘤微环境中营养和代谢产物的平衡可以显著影响代谢程序,改变免疫细胞反应。靶向关键代谢通路正在成为一种调节免疫功能极具前景的策略,研究也已证明,它能强烈影响免疫检查点疗法和过继性 CAR-T 疗法的有效性。
实时监测免疫细胞对检查点阻断的反应 苯扎贝特通过激活杀伤性 T 细胞的线粒体呼吸来促进生存和增殖并改善效应功能,从而增强 PD-L1 阻断在抗肿瘤免疫中的有效性。
苯扎贝特通过激活杀伤性 T 细胞的线粒体呼吸来促进生存和增殖并改善效应功能,从而增强 PD-L1 阻断在抗肿瘤免疫中的有效性。
摘自 Chowdhury, P. S. et al. PPAR-Induced Fatty Acid Oxidation in T Cells Increases the Number of Tumor-Reactive CD8(+) T Cells and Facilitates Anti-PD-1 Therapy. Cancer Immunol Res. 2018. 6 (11): 1375-1387.
监测免疫细胞的适应性和功能
细胞生物能量代谢在决定基因工程改造免疫细胞的命运中发挥重要作用
核心代谢通路决定过继性 T 细胞疗法的效价和持久性
“人们对能量代谢如何真正调节核心免疫功能非常感兴趣。大部分工作都来自于我们对 T 细胞的理解和研究:代谢如何调节 T 细胞分化和 T 细胞的效应功能。”
John Connolly 博士
Tessa Therapeutics Ltd 首席科学官
分子与细胞生物学研究所 (IMCB)
研究主管

线粒体功能障碍已被认为是导致神经退行性疾病的最常见原因,其主要与呼吸功能障碍 (OXPHOS)、代谢中间体稳态改变和细胞死亡机制触发有关[25]。鉴定影响线粒体代谢功能的特定蛋白质,有助于了解神经退行性疾病的潜在药物靶点。
线粒体是负责产生能量 (ATP) 和调节对细胞稳态至关重要的其他几个过程的细胞“发电厂”。神经细胞的能量需求高,且具有有限的再生能力;因此,这些细胞的存活高度依赖线粒体功能。事实上,越来越多的证据表明,线粒体蛋白和线粒体功能障碍是神经退行性疾病发病的原因,包括阿尔兹海默病、帕金森病、亨廷顿氏病和肌萎缩侧索硬化症 (ALS)。
靶标:线粒体功能障碍中的线粒体蛋白和中间体
测量代谢通路活性和中间体的研究表明,线粒体功能障碍是引起神经退行性疾病的主要原因。代谢靶标和关键驱动因素归因于:遗传突变(mtDNA 突变)、线粒体膜通透性和膜电位破坏、线粒体融合或裂变破坏、蛋白质和离子稳态受损、活性氧或者有毒聚集体的积累以及线粒体自噬功能失调。
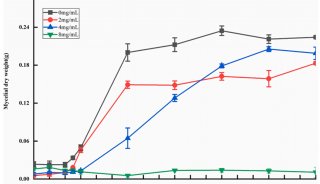
线粒体备用呼吸能力是神经退行性疾病的一项强大指标
摘自 Theurey, P., et al. Systems biology identifies preserved integrity but impaired metabolism of mitochondria due to a glycolytic defect in Alzheimer's disease neurons. Aging Cell. 2019.18 (3): e12924
表 2 列出了一些已作为神经退行性疾病的潜在靶点得到研究的线粒体蛋白质。与神经退行性疾病中的其他药物靶点相比,线粒体蛋白代表了相对较新的药物开发靶点。尽管以线粒体蛋白为靶点的疗法进入临床试验阶段的很少,但它们代表了一个有前景的新靶点领域。
表 2. 有前景的神经退行性疾病代谢靶标的示例
线粒体丙酮酸代谢负责控制神经功能和兴奋毒性死亡
“这些年来,我们的研究中一直存在很多局限性,直到开发出高通量呼吸测量法后,通过使用该方法可以了解很多信息,还可以提高数据收集速率。”
Anne N. Murphy 博士
加州大学圣地亚哥分校
药理学教授

营养物质过剩和压力过大的相关环境因素是肥胖的主要驱动因素,进一步导致并发症的出现,包括 2 型糖尿病和心血管疾病。调控代谢靶标以恢复能量稳态平衡至“正常”,代表了用于逆转或预防这些破坏性综合征有前景的治疗策略。
不同组织使用不同的营养物质来满足它们的能量需求。过量营养物质和底物可用性或长期暴露于错误的底物平衡会产生一系列影响,包括脂肪组织增加、炎症和胰岛素抵抗。鉴定具有能量底物摄取和利用活性的蛋白质(包括代谢通路和中间体)是潜在的药物靶点来源。
靶标:脂质与葡萄糖代谢和胰岛素抵抗
作为能量来源的脂质代谢和葡萄糖代谢之间存在负反馈。脂肪酸氧化与葡萄糖氧化(包括线粒体解偶联减少)之间的能量平衡受底物摄取和利用中蛋白质和酶活性的影响。
发现工作流程演示
采用创新干细胞代谢分析研究扩增和诱导棕色脂肪组织的天然产物
Shahzad Ali 博士
Plasticell Limited
高级研究科学家
表 3 列出了先前已作为与肥胖、糖尿病和心血管疾病相关代谢紊乱的潜在靶标得到研究的蛋白质
表 3. 用于糖尿病、心血管和其他获得性代谢紊乱的有前景代谢靶标的示例
心肌细胞中线粒体 ß 氧化受损:心脏肾素-血管紧张素系统和 miR-208 的作用
“糖尿病性心肌病的发病机制非常复杂。糖尿病心脏病变的核心是能量底物利用和代谢的改变。”
Margriet Ouwens 博士
德国糖尿病中心
DDZ
临床生物化学和病理生物化学研究所
扫描二维码或点击按钮,即可下载全文

下载电子书
参考文献
1. Hanahan, D., & Weinberg, RA. (2011) Hallmarks of Cancer. The Next Generation. Cell. 144(5), 646-674.
2. Chan, D. A. et al. (2011) Targeting GLUT1 and the Warburg effect in renal cell carcinoma by chemical synthetic lethally. Sci. Transl. Med. 3, 94ra70.
3. Timmerman, L. A. et al. (2013) Glutamine sensitivity analysis identifies the xCT antiporter as a common triple-negative breast tumor therapeutic target. Cancer Cell. 24, 450–465.
4. Polanski, R. et al. (2014) Activity of the monocarboxylate transporter 1 inhibitor AZD3965 in small cell lung cancer. Clin. Cancer Res. 20, 926-937.
5. Birsoy, K et al. (2013) MCT1-mediated transport of a toxic molecule is an effective strategy for targeting glycolytic tumors. Nature Genet. 45, 104–108.
点此查看全部参考文献>>>