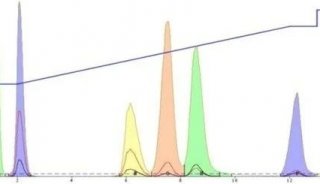
通过Empower软件部署符合GMP等法规的系统环境
现今,符合法规已成为一些分析实验室所面临的最大挑战。时刻关注法规最新动态,如cGMP/GLP、GAMP、EU Annexes、21 CFR Part 11,并解释FDA、ICH、美国、欧洲和日本药典的规定同样也是艰巨的工作。并且,如果试图通过手动设置的方式执行法规也是种灾难性的工作流程。
2010年卫生部审议通过了《药品生产质量管理规范(2010年修订)》,并于2011年3月1日起施行。《药品生产质量管理规范》(以下简称GMP)是药品生产和质量管理的基本准则。新版的药品GMP中对色谱数据的相关要求不但在以前的版本中没有出现过,而且明显接近了FDA 21CFR Part 11中有关电子记录的要求。
通过选择一个灵活的和可扩展的符合法规的解决方案,例如Empower软件,企业就可以解决法规符合性问题,并从中受益。
强大的数据报告功能
通过使用Empower交互式创建和修改报告的内容和设计,可以在整个实验室内以一致的方式轻松地共享数据。如果需要符合“现行药品生产质量管理规范”(cGMP)、“药品非临床研究质量管理规范”(GLP)以及21 CFR Part 11等法规,报告是一项重要功能。
用户可使用Empower创建包含同结果有关的统计信息的单个报告或综合报告,也可以根据自己需求,对报告的内容、格式、显示方式等细节进行全面的调整或设计。下图就是根据药品GMP规定编辑的报告。
Empower的报告功能同时也支持电子签名(ES)。如果实施CFR 21 Part 11的电子签名部分的法规,则可以完全替代传统的纸张形式报告签署。
全面的审计追踪功能
在Empower软件中预置了很多法规符合性方面的选项,因此可称之为“Compliance Ready”。这些选项均可通过系统策略(System policy)进行查看与设置。如果在法规环境下工作,推荐选中标有[GxP/ER]的选项,如果执行FDA电子签名法规, 推荐选中标有[ES]的选项。
GMP第一百六十三条要求,“只有经过授权的人员方可输入或更改数据”,则可以根据授权的分级在Empower软件内设置不同的用户类型,同时授予“管理”“方法”“采集”三个类别中相应的权限。下图所显示的就是如何设置用户类型:

一旦创建了不同的用户类型,就可以在创建用户帐号时指定用户类型而赋予相应的权限(如下)。

“更改和删除情况应当有记录”则通过审计追踪完成。所谓审计追踪,就是对于可重建的历史中事件(可以被计算机执行的动作)序列的记录。它记录操作人员的登录以及创建、修改和删除的动作,是关于人员、事件、时间和原因的文档,并且,最关键的是审计追踪是独立地由操作者的计算机系统自动创建的。GxP要求所有的信息均具有可追溯性,通过审计追踪可以提供详细的操作记录,便于监督检查。
在Empower软件中,可以记录的审计追踪信息有以下几种类型:
样品审计追踪:记录关于每个样品的输入数据的改变
结果审计追踪:
链接到仪器、样品组、方法、校正曲线、以及校正曲线中使用的标样
也记录任何手动操作的数据
方法审计追踪:
保留创建结果的方法的所有版本
审计追踪检测每一个改变,改变之前和之后的值,谁,何时以及为何要改变
不同的版本可以通过比较而确认彼此的差异
项目审计追踪:
提供遍项目中所有个改变的浏览
包括方法/数据删除的详细信息
系统审计追踪:
显示系统对象和系统策略的变化
归档活动的详细信息
记录所有安全性相关的改变(用户、用户类型等)
记录所有成功与不成功的登录
所有人登录应用程序的历史
下图显示了在系统策略中如何设置项目的审计追踪,我们不仅可按照药品GMP的要求选择相应的审计追踪记录项,也可以更加严格地设置,当一些重要操作发生时,例如删除数据时,需要再次输入密码以确认身份,防止误操作。

对于“用密码或其他方式来控制系统的登录”这一要求,在Empower软件的系统策略中有专门的“用户帐户”策略(如下)可以进行参数设置。

通过“密码过期”、“限制尝试登录次数”以及“强制使用密码最小长度”等一系列选项,可以确保帐号与密码组合的完整性和安全性,从而完全达到药品GMP的要求。
安全的数据备份功能
用电子方法保存的批记录,应当采用磁带、缩微胶卷、纸质副本或其他方法进行备份,以确保记录的安全,且数据资料在保存期内便于查阅。
Empower软件有完整的数据备份功能,可以根据需要在任何时候进行数据的备份/还原。数据通过项目进行管理,所以,数据备份主要是通过项目备份进行,且备份的项目可以在任何Empower软件上还原,所有信息均可完好恢复。
如果使用的是Empower软件工作组版或者企业版,还可以通过软件中预先写好的脚本文件进行数据以及数据库的完整备份。备份的方式和频率可以根据备份SOP进行设置。结合工作组版或企业版特有的物理安全性,数据的安全更有保障。
综上所述,通过Empower软件的简单设置即可实现药品GMP的相关要求。Empower的强大功能绝非仅此而已,还可根据cGMP/GLP、GAMP、EU Annexes、21 CFR Part 11的要求进行更全面、严格的设置。除此之外,通过Empower软件内置的计算与自定义功能,使用者可以消灭数据手工传递的抄写错误,减少对第三方电子表格软件的依赖,进一步保证数据的安全性与可追溯性,从而提高实验室效率并确保完全符合法规。