Nat Met | 刘兴国组报道乳酸化修饰介导细胞命运的“表观组-代谢组-表观组”跨界调控
景杰学术 | 报道
长久以来,乳酸都被视作无氧条件下细胞呼吸代谢产生的“废物”。然而,近些年来一些新兴的证据表明,在哺乳动物中,乳酸也可作为一种主要的可循环碳水化合物燃料,或是作为可循环的氧化还原缓冲液,用于平衡细胞和组织中NADH/NAD的比例。2019年10月,芝加哥大学赵英明教授团队在Nature发文,首次发现乳酸能够可以作为前体物质导致组蛋白赖氨酸发生乳酸化修饰,并参与细菌感染的M1巨噬细胞的稳态调控(Nature重大突破:全新组蛋白乳酸化修饰调控癌症和炎症等疾病)。这一重磅研究结果拓宽了代谢调控的边界,引发了乳酸化研究的热潮。2020年7月20日,Nature Metabolism发表观点文章,为乳酸“正名”,认为这一代谢领域的丑小鸭正在成为代谢重塑的白天鹅(Nature Metabolism | 为乳酸正名:能量代谢中的丑小鸭)。
2020年8月24日,Nature Metabolism在线发表了中科院广州生物医药与健康研究院刘兴国团队题为“Glis1 facilitates induction of pluripotency via an epigenome–metabolome–epigenome signalling cascade”的最新成果。该研究表明了母系转录因子Glis1实现衰老细胞重编程并稳定基因组的强大功能,并进一步提出由Glis1调控多能干细胞命运的“表观组-代谢组-表观组”的跨界级联反应新概念,糖酵解代谢驱动的组蛋白乙酰化和乳酸化修饰在表观遗传组连接中发挥核心作用。

诱导多能干细胞(iPSC)的重编程机理在表观层次、转录层次、代谢层次、细胞器层次以及细胞层次等不同层次被广泛研究。然而,重编程中多层次是否及怎样“跨界”调控干细胞命运,依然存在诸多未知。
在该研究中,研究人员着眼于新型转录因子Glis1,它由日本京都大学的山中伸弥(Shinya Yamanaka)教授于2011年首次发现的,是联系iPS诱导和细胞核转录后重编排的重要因素。研究发现Glis1不仅促进正常细胞重编程,并且能够实现衰老细胞重编程,由Glis1得到的iPSC基因组更加稳定。结果表明Glis1是一个强有力的细胞命运决定因子。
随后,研究人员运用景杰生物提供的乳酸化修饰抗体,结合染色质免疫共沉淀测序和转录组测序联合分析、靶向代谢物组学等多组学技术,全面解析并归纳了Glis1调控多能干细胞命运的“表观组-代谢组-表观组”的跨界级联反应新机制。

图1 多能干细胞命运调控的 “表观组-代谢组-表观组”的跨界级联反应
阶段1:随机阶段(Stochastic phase),发生在重编程早期,Glis1与体细胞基因和糖酵解基因的启动子结合,关闭体细胞基因的表达,同时开启糖酵解基因的表达。
阶段2:化蛹成蝶阶段(Metamorphosis phase),在这一阶段,线粒体氧化磷酸化未受影响,而糖酵解基因的表达激活,因此促进了细胞从线粒体氧化磷酸化到糖酵解的代谢重塑。上调的糖酵解会产生更多的代谢物:乙酰辅酶A和乳酸。这两类代谢物是酰化修饰的供体,是连接代谢与表观遗传的关键分子。
阶段3:决定阶段(Deterministic phase),阶段2产生的乙酰辅酶A和乳酸,分别通过组蛋白乙酰化修饰和乳酸化修饰,在染色质水平打开并促进“第二波”基因和多能性基因的转录表达,加速多能性的获得。

图2 Glis1通过组蛋白H3K27Ac和H3K18la,调控多能性基因的转录表达
研究结果证明了转录因子Glis1,通过独特的代谢重塑机制,来实现表观基因组信号的级联扩增。该过程并非从基因组层面完成,需要“代谢”水平跨界来连接,从而形成细胞命运调控的“表观组-代谢组-表观组”跨界级联反应。组蛋白乙酰化修饰和乳酸化修饰,连接代谢组与表观组,在该调控过程中发挥核心作用。
值得一提的是,本研究发现由乳酸产生的新型组蛋白乳酸化修饰调控细胞干性,进一步拓展了我们对于乳酸化修饰的潜在生理病理功能的认识。同时,Glis1不仅在母系细胞中高表达,在病理条件例如癌细胞中同样高表达,提示我们这一跨界级联反应的重要病理意义。这一概念同样适用于众多表观因子,为细胞与发育的生理调控和病理发现提供了全新的理论基础。
参考文献:
1. Di Zhang, et al., 2019. Metabolic regulation of gene expression by histone lactylation. Nature.
2. Joshua D. Rabinowitz, et al., 2020. Lactate: the ugly duckling of energy metabolism. Nature Metabolism.
3. Linpeng Li, et al., 2020. Glis1 facilitates induction of pluripotency via an epigenome–metabolome–epigenome signalling cascade. Nature Metabolism.
★文末福利★
乳酸化修饰作为代谢重塑的“白天鹅”,已成为备受关注的研究热点。
想了解乳酸化的发现及其潜在应用,欢迎转发此文至朋友圈,截图发送至小编微信(微信账号ptm-market),获取乳酸化Nature一作,芝加哥大学张迪博士学术讲座视频。

乳酸化精彩推荐
“多面手”乳酸调控之---肿瘤微环境
2020-08-21

Nature Metabolism | 为乳酸正名:能量代谢中的丑小鸭
2020-08-03

Nature重磅:翻译后修饰家族“新宠”,全新乳酸化修饰研究如何展开?
2020-07-23

Cell Metab | 张静等揭示乳酸调控肌肉再生的分子机制
2020-06-03

深挖2019年诺奖热点,低氧-乳酸调控在免疫炎症抑制中的关键功能
2020-02-14


-
仪器推荐
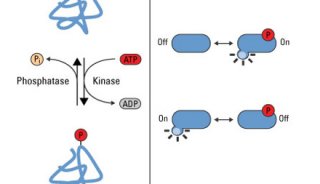 询底价 Tel:400-6699-117 转 3981
询底价 Tel:400-6699-117 转 3981 -
仪器推荐

-
仪器推荐

-
仪器推荐
-
仪器推荐

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章
-
微信文章
-
微信文章


















