Nature Medicine:肠道菌群-代谢物互作导致肝脂肪变性的发生
Nature Medicine杂志新刊登一项非酒精性脂肪性肝病的多国合作研究成果并进行了评述。该研究在非糖尿病肥胖女性患者人群中,综合分析了粪便宏基因组、肝脏组织转录组、血浆及尿液代谢组,并通过粪菌移植和体外细胞实验,明确了肠道菌群及代谢物在肝脂肪变性中的作用,证实了菌群关键代谢物苯乙酸(PAA)可引起肝脂肪变性。
该研究收集非病毒性肝炎肥胖女性患者时,排除了高血糖、或者使用二甲双胍药物的患者。肝脏脂肪性病变程度根据欧洲肝脏研究协会(EASL)、欧洲肥胖研究协会(EASO)、欧洲糖尿病研究协会(EASO)指导准则进行诊断。此外,考虑到肠道菌群对胰岛素抵抗的影响,纳入病例时还对受试者进行了葡萄糖耐受量试验、正常血糖-高胰岛素钳夹试验。最终纳入总病例数为105例:西班牙病例44例,意大利61例。这些同质群体将保证在混杂因素中重点探讨与解释脂肪变性中的关键因素。


宏基因组分析肝脂肪变性
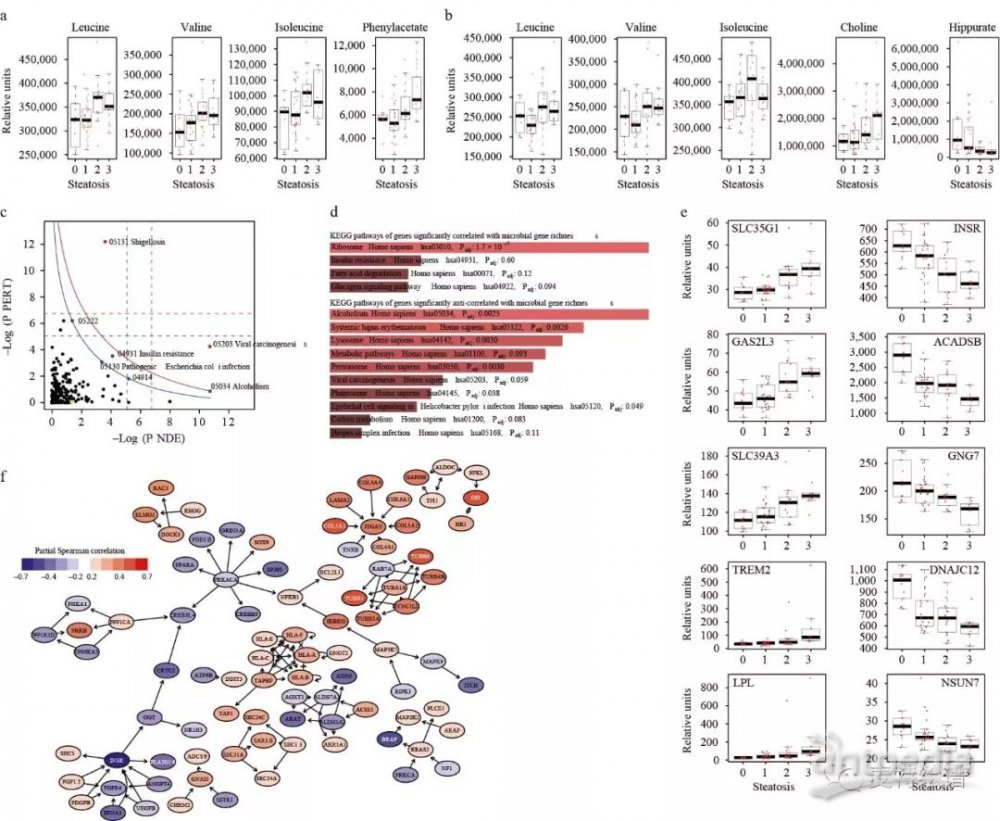
为了获得肝脂肪变性患者体内肠道菌的详细分类和功能信息,作者对患者粪便进行了宏基因组测序。测序结果显示微生物基因丰度(MGR)与肝脂肪变性呈显著负相关(0级:665,063 ± 126,062,3级:517,989 ± 126,062;n=10, P=0.03, Fig.2a),与肝功能指标(γ-谷氨酰转移酶、丙氨酸氨基转移酶、炎症C反应蛋白)亦呈负相关(Fig. 2b)。从菌群门属水平对菌群与肝脂肪变性、临床指标进行相关分析,作者发现Proteobacteria, Actinobacteria和Verrucomicrobia与肝脂肪变性为正相关,而Firmicutes和Euryarchaeota为负相关,Chao1丰富度估计量结果显示菌种多样性与肝脂肪变性无关。通过KEGG进行功能注释,作者发现肝脂肪变性、胰岛素抵抗与菌群脂肪酸、糖代谢、氨基酸(包括芳香族氨基酸AAAs和支链氨基酸BCAAs)和LPS及肽聚糖合成代谢通路水平上调有关。


代谢表型与肝脂肪变性的分子机制
作者又对血浆和尿液样本进行了代谢组学检测。尿液和血浆中分别发现124和80个代谢物与肝脂肪变性及临床特征相关,同时大多数代谢物还与低MGR存在相关性,其中血浆BCAAs(亮氨酸、缬氨酸、异亮氨酸)与尿液中亮氨酸、异亮氨酸为主。在微生物-宿主共代谢物中,血浆苯乙酸(PAA)与肝脂肪变性和低微生物基因丰度呈现了最强的正相关性(p-FDR = 4.69×10−5)。PAA主要是拟杆菌属参与芳香族氨基酸(苯丙氨酸)代谢的产物之一。除PAA之外,还有诸多和肝脂肪变性相关的共代谢物,如尿液中的苯乙酰谷氨酰胺和血浆中的乙酸和TMAO。作者进一步采用UPLC–MS/MS和同位素标记的标准品证实了TMAO而不是TMA与肝脂肪变性负相关。这些研究结果表明存在与肝脂肪变性和低微生物基因丰度相关的代谢表型,即升高的BCAAs、AAAs、微生物代谢物水平和可能的肝脏氧化、结合微生物代谢物功能的失衡存在相关。
为了进一步明确肠道菌群和肝脂肪变性相关的分子机制,作者对肝组织进行转录组检测,分别找到3386个基因与肝脂肪变性正相关,3201个基因与肝脂肪变性负相关。人类基因与MGR相关分析发现,1776个呈正相关,而这些大都和肝脂肪变性显著负相关;1805个呈负相关的基因则和肝脂肪变性正相关。这和宏基因组发现的肝脂肪变性与MGR之间则呈负相关性的结论一致。信号通路影响分析(SPIA)表明肝脏基因表达与血浆、尿液的代谢特征一致, BCAAs升高伴随低MGR、肝脂肪变性和胰岛素抵抗,进一步强调了三者间的相互关联性。

菌群移植与PAA饮食添加实验验证
前文展示的结果已暗示了肠道菌群对于肝脂肪变性的贡献。那非糖尿病肥胖患者的菌群是否会诱导健康个体出现肝脂肪变性?作者将正常人体0级及肝脂肪变性3级患者的粪便分别移植至小鼠体内,发现移植肝脂肪变性患者的菌群小鼠肝脏甘油三酯含量、 Fabp4(脂肪酸结合蛋白)表达及血浆中缬氨酸水平均增加,说明菌群移植对小鼠肝脂肪堆积有显著影响。供体粪便的菌群组成和小鼠表型显著相关,如肝甘油三酯、BCAAs和TMAO代谢物水平。受试小鼠的菌群组成亦有相似的相关性,尽管更弱。肝内脂质的快速积累表明肝脂肪变性患者的粪便微生物群在引发肝脏脂肪变性中起重要作用。

肠道菌群对肝脂肪变性的影响是如何实现的呢?通过肠道菌群功能分析及代谢组学分析最终筛选出与肝脂肪变性相关性最强的微生物代谢物苯乙酸(PAA),并对棕榈酸(PA,已知的可引起肝脂肪变性的一种游离脂肪酸)与PAA对人原代肝细胞脂质积累、相关基因表达、BCAAs代谢和消耗等展开研究。结果显示,PAA与PA对人原代肝细胞中甘油三酯的积累存在协同作用,并诱导脂质代谢基因(LPL、FASN)水平发生变化,尤其引起GLUT2表达水平降低。PAA可降低AKT磷酸化作用,说明其降低了细胞对胰岛素的反应。PAA增加ACADSB表达从而增加细胞从培养基中摄取BCAAs。给予小鼠两周含PAA饲料喂养,发现肝甘油三酯水平升高、异亮氨酸水平降低。由此表明PAA作为肝脂肪变性相关的菌群代谢物可以提高肝脏BCAAs代谢及肝脏脂质积累。


代谢组临床意义
基于所有的数据,作者量化了不同数据集的对话。宏基因组的数据和临床指标、肝转录组及血清代谢组共享了92-93%的相似度。尽管有如此强的相似度,每个数据集依然拥有自己独特的信息,这提示将所有信息整合将得到显著的肝脂肪变性特征。作者通过OPLS-DA构建了宏基因组、转录组学和代谢组学信息的多变量诊断模型,肝转录组、尿液代谢组和血浆代谢组的ROC曲线下面积AUC达到87%,而只采用目前临床数据,AUC仅为58%。另外,血浆代谢组的AUC可达79%,显示了良好的临床诊断潜力。在未来,通过代谢组学技术寻找到的Biomarker可能对监测肝脂肪变性发展阶段、预测疾病发展方向等临床应用具有指导意义。

本研究对西班牙、意大利两个中心经严格遴选的非糖尿病肥胖女性患者开展粪便宏基因组、血浆/尿液代谢组学、肝脏组织转录组学与脂肪变性之间的关联展开研究,揭示了非糖尿病肥胖女性群体中肠道微生物组引起肝脏脂肪变性的分子机制。肝脂肪变性与MGR呈负相关,证实MGR在代谢性疾病中的重要作用;宏基因组的功能分析发现非糖尿病肥胖肝脂肪变性患者微生物来源的氨基酸代谢增加,同时阐释了肝-肠循环失衡在非糖尿病肥胖肝脂肪变性患者中的重要作用。通过宏基因组学与代谢组学数据联合分析发现:由微生物降解AAAs生成的PAA对于肝脂肪变性具有直接作用,细胞实验和动物实验相继证实了PAA在肝脂肪变性中扮演的重要角色。
文章第一作者Hoyles博士指出产物PAA是肠道菌促进脂肪肝变性中重要的一个环节,但PAA并不是唯一的参与者,这个表型是多因素共同作用的结果。文章的数据暗示了针对苯丙氨酸和酪氨酸的补充或菌群代谢这些氨基酸的途径存在潜在的治疗前景。人体每天都有大量的食源性蛋白质进入肠道,因此可以针对相关蛋白质展开定性、定量研究。此外,本研究针对非糖尿病肥胖女性患者人群中的肝脂肪变性展开讨论,那么非糖尿病肥胖男性患者中又有何变化?肥胖患者中糖尿病患者、非糖尿病患者又会出现怎样的改变?肥胖患者中哪些人群易发展为脂肪肝患者,哪些人群易发展为糖尿病患者,众多研究点值得进一步研究与讨论。




长
按
关
注
解锁更多更精彩的「代谢组学」相关资讯!
微信公众号:麦特绘谱
Tel:400-867-2686
Web: www.metaboprofile.com
-
微信文章

-
微信文章
-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章









