看完这篇文章,我不信您还搞不定「双荧光素酶报告实验」

在基因表达调控的研究中,报告基因广泛应用,如荧光蛋白、真核抗性和荧光素酶等。今天小编主要为大家简述一下荧光素酶报告基因系统,荧光素酶的种类很多,其中应用较为广泛的是萤火虫荧光素酶(Firefly luciferase,FLUC)和海肾荧光素酶(Renilla luciferase,RLUC)。

(一)荧光素酶介绍

1. 萤火虫荧光素酶
萤火虫荧光素酶催化的发光反应原理为在ATP、Mg2+和O2存在的条件下,虫荧光素在虫荧光素酶的催化下氧化发光,发光颜色为黄绿色。

图1. 萤火虫荧光素酶催化反应原理
萤火虫荧光素酶一般是作为主报告基因,将目的基因构建在该载体上,从而反应目的序列的作用结果,因此根据我们的实验目的,可以针对此质粒进行改造,载体的工作原理如下图所示:
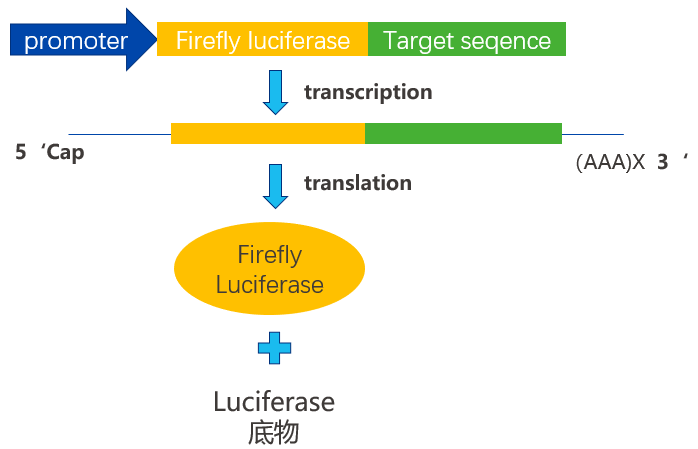
图2. 萤火虫荧光素酶载体工作原理
2. 海肾荧光素酶
海肾荧光素酶催化的发光反应需要腔肠素和O2的参与,发光颜色为蓝色。

图3. 海肾荧光素酶催化反应原理
海肾荧光素酶通常作为内参报告基因,在实验操作的过程中,常遇到由于个人操作造成的实验误差,比如细胞数目不均一、细胞代次不统一、转染效率不一致等。引入一个内参报告基因,以此来标定检测用报告基因的测量结果,从而达到有效地减少实验误差的目的,载体的工作原理如下图所示:
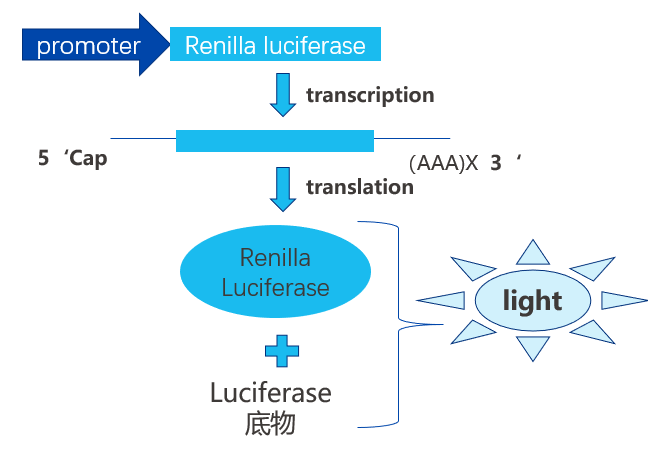
图4. 海肾荧光素酶载体工作原理

(二)双荧光素酶报告系统

Dual-Luciferase双萤光素酶报告基因检测系统在细胞中同时表达萤火虫萤光素酶和海肾萤光素酶,两者没有种源同源性并对应不同的反应底物,故而没有交叉干扰。以Luciferase为核心,构建研究对象到相应位置,转染细胞,裂解细胞,分别加荧光素酶底物,用荧光测定仪检测荧光强度,通过数据得出基因表达量,从而确定构建序列的功能。双报告基因则通过共转染的“对照”作为内参为试验提供一基准线,从而可以在最大程度上减小细胞活性和转染效率等外在因素对实验的影响,使得数据结果更为可信。

(三)实验流程

1. 实验步骤流程

图5. 双荧光素酶报告基因实验流程
2. 具体实验步骤
(1)目的细胞准备:
a) 细胞培养:生长 90%汇合的细胞进行传代培养。
b)细胞铺板:取对数生长期的细胞制成细胞悬液,计数,接种于 24-well 培养板中(细胞数约为105,具体根据细胞形态大小而定)。37℃、5% CO2培养箱培养至细胞融合度达到约 60%。
(2)目的细胞质粒转染(以miRNA-靶基因验证为例):
a) 按照转染试剂要求将报告基因质粒与转录因子表达质粒共转染细胞,参考实验分组排布如下图所示:

图6. 实验24孔板排布参考

(四)应用方向

双荧光素酶报告系统最常见的应用方向主要有两种:
1. 转录因子-启动子
启动子能活化RNA聚合酶,使之与模板DNA准确地相结合并具有转录起始的特异性;转录因子(TFs)调节基因表达,保证目的基因以特定的强度在特定的时间与空间表达的蛋白质分子。将启动子区域序列插入到报告基因载体(常用载体为pGL3-Basic Vector,将待检测的启动子序列构建在报告基因上游),同时在细胞实验中共表达转录因子,分析荧光素酶表达水平,反应转录因子是否影响基因表达情况。
(1)实验分组参考
分组序号 | 分组名称 |
实验组 1 | Promoter-NC+TFs-NC |
实验组 2 | Promoter-NC+TFs |
实验组 3 | Promoter +TFs-NC |
实验组 4 | Promoter+TFs |
(2)数据处理
启动子活性检测的数据处理比较简单,将同一样品孔内Firefly Luciferase值与Renilla Luciferase值的比值Firefly /Renilla luminescence作为luciferase相对表达量
(3)数据分析
通过荧光值对比确定哪一区域为核心区,luciferase表达强度显著降低说明转录因子能抑制启动子的启动能力。
2. miRNA-靶基因
3‘UTR是位于编码基因终止密码子下游延伸至多聚A尾巴(Poly-A)的前端,通过自身结构或者与其他分子相互作用调控基因表达,miRNA大部分通过成熟体种子区与3’UTR结合抑制蛋白翻译。将待验证序列插入到报告基因载体的3‘UTR区域,再共转入microRNA,如果荧光素酶表达下降,则待验证序列是miRNA靶序列。
(1)实验分组参考
分组序号 | 分组名称 | 分组情况说明 |
实验组1 | 3’UTR-NC+ miRNA-NC | 靶基因3’UTR阴性对照质粒与microRNA(阴性对照)及其对照质粒(实验体系对照)共转 |
实验组2 | 3’UTR-NC+miRNA | |
实验组3 | 3’UTR+miRNA-NC | 野生型靶基因3’UTR质粒分别与microRNA及其对照质粒共转染(目的实验组) |
实验组4 | 3’UTR+miRNA | |
实验组5 | 3’UTR-MU+ miRNA-NC | 靶基因3’UTR质粒序列进行突变,分别与microRNA及其对照质粒共转(与实验组4进行比较,进一步验证) |
实验组6 | 3’UTR-MU+ miRNA | |
阳参miRNA NC组 | 阳参3'' UTR + miRNA-NC | |
阳参miRNA组 | 阳参3'' UTR + 阳参miRNA | |
(2)检测体系中各质粒名称说明
miRNA-NC | microRNA空载质粒,作为目的microRNA质粒阴性对照 |
miRNA | microRNA载体质粒,表达目的microRNA |
3'' UTR-NC | 3'' UTR空载质粒,作为靶基因3'' UTR质粒阴性对照 |
3'' UTR | 靶基因3'' UTR质粒 |
3'' UTR-MU | 靶基因3'' UTR突变体质粒 |
(3)数据处理
a) Firefly /Renilla luminescence:同一样品孔内Firefly Luciferase值与Renilla Luciferase值的比值,代表luciferase相对表达量(消除操作误差)。
b)Firefly /Renilla luminescence fold change:同一Luciferase质粒转染的两个组中,将miRNA-NC组luciferase相对表达量均一化为1,目的miRNA组相比miRNA-NC组后,其luciferase相对表达量(消除在3'' UTR空载体质粒下,miRNA质粒和miRNA NC质粒造成的误差,该误差在20%范围内属于正常情况)。
c)Normalized fold change:将UTR-NC组量化为1后,比较在相同的miRNA的作用下,UTR组和UTR突变组的luciferase相对表达量。
(4)结果分析
是不是很复杂,结果看不懂?不用害怕,很多组都只是对照而已,真正要看的关键数据是第4组和第6组的数据,记住这句话:第4组数据死命低,其他各组数据差不多你就赢了!

(五)常见问题及解决方法

Q1:关于荧光的问题-荧光值过高
荧光值过高可能会超出仪器检测范围,从而检测不到值,一般读数在5-6位之间较好。荧光值过高可通过以下方式尝试解决:
1.减少质粒转染量;
2.细胞样品裂解后,离心取上清后检测或对裂解产物进行稀释后检测。
(注:不建议通过减少底物量来降低荧光值,需要保证底物的饱和来反映荧光素酶真实的表达水平,否则会造成检测结果出现大的偏差。)
Q2:关于荧光的问题-荧光值过低或无荧光值
1. 启动子活性低
a.优化细胞的培养条件,提高荧光素酶的表达量;
b.更换强启动子(如SV40、CMV)。
2. 转染效率低
a.优化转染实验条件,用较易转染的质粒做阳性对照(如转染过表达荧光蛋白质粒);
b.确保转染DNA的质量,可通过酶切或琼脂糖凝胶电泳的方法对DNA质量进行鉴定;
c.选择活性较高,处于指数分裂期的细胞进行转染。
3. 样品裂解效率低
a.细胞培养时间不宜过长,12-36h内最好,长时间培养后,细胞可能会难裂解;
b.加入的裂解液需足量,保证细胞能够充分裂解。
4. 荧光信号衰减
荧光素酶的半衰期一般约30min,加完底物后可立即检测,尽量在30min内完成。
5. 底物氧化失效
a.底物避光密封保存,萤火虫荧光素酶底物-20℃保存;海肾荧光素酶底物推荐-80℃保存;
b. 反应工作液建议现用现配。
Q3:如何判断实验体系无异常,获得客观的实验结果?
可以从以下几个方面来考察实验结果的客观性:
1. 对照的2个实验组,即实验组1与实验组2 luc表达情况应无显著差异;
2. 转染正常,质粒或mimic确保成功转染入细胞;
3. luc检测值在仪器检测线性范围内。
Q4:如何判断转染成功?
1. 如转入的miRNA带荧光标记如GFP,则可直接在转染后、细胞裂解前,显微镜下观察细胞荧光;
2. 如转入的miRNA不带任何荧光标记,可考虑进行miRNA的qRT-PCR检测,通过检测结果判断实验组2、4、6是否相对其对照组miRNA有显著过表达;
3.设置一个荧光质粒转染参照组,同批转染一个组的细胞,间接反映出同批次实验的转染情况。



1.实验技术干货
2.蛋白质组学研究
3.腺病毒简介及应用
6.单细胞测序
8.悬浮细胞专用病毒
10.测序技术研究与应用
12.腺相关病毒选择/应用
13.表观遗传研究
14.文章解析
15.国自然课题设计思路解析
16.生物信息分析及工具
17.外泌体研究
18.肿瘤免疫研究
19.高分文章