重磅发布 | 代谢组学国家标准立项征求意见通知
3月29日,全国医用临床检验实验室和体外诊断系统标准化技术委员会(SAC/TC136)发布了拟对《分子体外诊断检验尿液,静脉血清和血浆代谢组学检验前过程的规范》等9项国家标准立项征求意见的通知。
百趣将其中关于代谢组学相关标准的文件进行了整理(需要全文PDF文件的老师可至文末添加小趣的微信进行获取),正文如下,供大家参考。

分子体外诊断检验尿液,静脉血清和血浆代谢组学检验前过程的规范
Molecular in vitro diagnostic examinations — Specifications for pre-examination processes in metabolomics in urine, venous blood serum and plasma (ISO 23118:2021)
引言
代谢组学是研究代谢物特征的“组学”科学,继而又被定义为细胞、组织、器官或整个生物系统中的所有小分子(分子质量<2000 Da)的集合[1]。分析主要通过两种主要的分析技术进行,即质谱(MS)和核磁共振(NMR) [2] [3] [4]。前者的灵敏度可低至皮摩尔级别,需要样品分离和针对特定化合物种类的多轮实验。后者测量浓度在1μM以上的代谢物,主要用于非靶向分析,所有浓度高于检出限的代谢物可进行同时观测,不依赖于其化学性质,也无需任何分离程序。
代谢物是动态的,对扰动非常敏感。在初级样品采集、运输、贮存和加工过程中,代谢产物会发生剧烈变化。因此,诊断和研究测量的结果可能会最终提供的是特定目标生理状态或点的不可靠表征,描述出的只是预检查过程中产生的人工轮廓。分析前的变异主要有两个来源:
a) 样品中的酶活性,主要与细胞的存在有关;
b) 代谢物之间或代谢物与氧之间的化学反应(如氧化还原反应),见文献[5]至[11]。
此外,添加剂的使用或污染物的引入都会影响分析结果,因此选择合适的收集管和塑料制品也是检验前过程的一个重要方面。
许多研究通过确定影响代谢物组成的关键步骤和参数来维持原始样品代谢物,从而确定来最佳的检验前过程规范。此外,需要对整个检验前过程进行标准化,以确保多中心研究的可比性。在目前的研究现状下,还没有明确的代谢组学样品检验前过程规范。因此,各中心采用的程序给样品代谢物带来了不同程度的影响,使其比较不可靠。采用这些研究提供的检验前过程规范,使比较和评价从代谢分析中得到的结果成为可能。
本文件借鉴这些研究,将尿液、血清和血浆代谢组学分析检验前过程的各步骤进行整理和标准化。
一、范围
本文件对拟用于代谢组学分析的尿液、静脉血血浆和血清的标本处理、记录和加工等检验前过程规范提出了要求和建议。本文件适用于代谢组学检测,可供生物医学实验室、实验室客户、体外诊断开发商和生产商、从事生物医学研究的机构和公司、生物库和监管部门使用。
二、规范性引用文件
下列文件中的内容通过文中的规范性引用而构成本文件必不可少的条款。其中,注日期的引用文件,仅该日期对应的版本适用于本文件;不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
ISO 15189:2012, 医学实验室:质量和能力认可准则;
ISO 15190, 医学实验室:安全要求;
ISO/IEC 17020:2012, 合格评定——各类检查机构的运作要求。
三、术语和定义
ISO 15189界定的以及下列术语和定义适用于本文件。
3.1生物体液biofluid
可排出(如尿液或汗液)、分泌(如母乳、唾液或胆汁)、通过取样针头获取(如血液或脑脊液)、或由于病理过程而产生(如水泡或囊肿液)的生物液体。
以确定一个特性的值或特征为目标的一组操作。
注1:从分离的分析物开始并包括各种用于定性或定量检验的参数测试或化学操作的过程。
注2:对于代谢组分析,分析物的分离不是必需的。
[来源:ISO 20166-1:2018,3.10;有修改,删除原术语“分析检测”增加注2]
3.3禁食fasting
停止食用除水之外的任何固体或液体食物至少8小时。
基于化合物的质荷比而对其进行分析的方法。
利用分析平台同时测量生物体系中的代谢物成分集合,这些代谢物可通过所使用(或所选定的)技术来进行测量。
示例:相关的测量技术如核磁共振波谱和质谱。
宿主生物体、微生物群落的小分子代谢中间产物和/或终产物(≤2 000 Da),它们来自于食物、饮料、药物或污染物。
注:更多信息参见参考文献[1]。
在生物体或生物样品中发现的完整的代谢物集合。
注:更多信息参见参考文献。
代谢物组学
对生物标品(如生物体、细胞、组织或生物体液)代谢组的全面分析。
利用质谱法测量生物样品中的代谢物。
基于在固定磁场作用下原子核对射频辐射选择性吸收的原理的一种方法。
注:NMR提供分子的化学和结构性质。
利用核磁共振波谱法测量生物样品中的代谢物。
未凝固血液的液体部分
注:血浆样本可含有抗凝剂。
分析前阶段preanalytical phase
分析前工作流程preanalytical workflow
按时间顺序从临床医生的申请开始,包括检验申请、病人的准备和身份识别、原始样品的采集、临时贮存、在分析实验室内和实验室间进行运输、分份、检索(retrieval)。
注:分析前阶段包括影响预期检验结果的准备流程。
[来源:GB/T 22576.1-2018,3.15,有修改——“分析前工作流程”被添加为首选术语,添加了更多细节] ( ISO 15189:2012,IDT)
标本 specimen
为检验、研究或分析一种或多种量或特性而取出的认为可代表全部的一独立部分的体液、呼出气、头发或组织。
[来源:GB/T 22576.1-2018,3.16,删除原注释。] ( ISO 15189:2012,IDT)
本文件中是指18℃-25℃。
可以从凝固的血液中分离出来的液体。
标准样品在规定条件下贮存时的特性,其某个规定特性值在规定时间内保持在规定限制范围内。
[来源:GB/T15000.2-2019, 2.1.15;删去原注](ISO Guide 30:2015,IDT)
四、总则
有关医学实验室质量管理体系的一般说明,特别是关于标本收集、接收和处理(包括避免交叉污染)的一般说明,可参见ISO 15189或ISO/IEC17020。对实验室设备、试剂和消耗品的要求也应遵循ISO 15189及ISO/IEC 17020的相关要求。
诊断工作流程的所有步骤都可能影响最终的分析测试结果,应对其进行风险评估(参见ISO 14971)。针对已确定的风险,应在需要的地方建立缓解措施进行消除或减少,以保证检验的顺利进行。尤其应研究并确保待测代谢物不会因为任何影响检测结果的行为而发生变化。可以通过如下方式做到这一点,例如,对标本/样品的检测前步骤进行逐一的时间曲线分析(比如运输和储存),然后识别出这些分析前变量对相应检测造成的影响,并采取措施防止或减少这些影响。
在没有合适的标本稳定技术的情况下,代谢组学的标本采集应在具备即时可用的合适的生物体液处理程序的医院场所或机构进行。
对于拟进行代谢组学分析的样本,以下事项应考虑到:
a) 患者的预处理(禁食,治疗等);
b) 从患者那里采集的标本;
c) 采集容器和包装的选择(例如收集管,冷却箱,用于存储和运输的箱);
d) 稳定程序的选择(例如为稳定样品而添加的任何化合物);
e) 对标本的任何添加或处理行为的记录;
f) 标本类型、数量以及描述的记录。
设施、运输和处理的安全要求应遵循ISO 15189、ISO 15190以及WHO关于传染性物质和诊断标本安全运输准则[14] 的要求。
五、尿液
5.1.1 尿液采集
5.1.1.1 总则
对于标本采集,拟实施的分子检验的需求(如疾病状态、标本大小)应予以考虑。
可参见ISO 15189要求。
5.1.1.2 标本供体/患者信息
记录应包括标本供体/患者的身份证明,可以用代码表示。
记录应包括但不限于下述信息:
a) 尿液供体的健康状况和相关的生活方式因素(例如健康、疾病类型、伴随疾病);
b) 人口特征(例如年龄,性别);
c) 药物治疗和尿液采集前任何治疗的信息(如麻醉剂、药物、诊断程序);
d) 采集时间,包括有关禁食、先前活动等信息。
e) 标本供体/患者的适当同意。
5.1.1.3 采集器具的选择和标签
实验室应规定其尿液采集的容器。
通常不使用添加剂,因为它们会干扰分析方法。如果因为某些原因确实需要添加,则应分析添加剂对分析性能和结果的影响。采集管中的某些添加剂可能对患者构成风险(例如毒性或腐蚀性)。
对于采尿管的标签(标本识别),应使用常规程序(可参见ISO 15189)或带有附加信息的程序(如二维码)。
5.1.1.4 标本供体的尿液的采集和接收
5.1.1.4.1 总则
应当向供体提供尿液采集的说明,包括在处理装有有害添加剂的采集容器时必须遵循的所有安全措施。应检查所有尿液采集设备与代谢组学的相容性,如应避免对代谢组学谱的任何干扰。
注:对于未经如厕训练的儿童,最流行的非侵入性方法是使用清洁收集法,英国国家卫生医疗质量标准署(National Institute for Health and Clinical Excellence,NICE),2007年将其定义为金标准。这主要是通过将无菌样本瓶保持在尿流中来收集样品。尿液采集袋和尿液采集垫也可用于采集尿液。NICE建议将尿液采集垫作为清洁收集法的下一个最佳选择。
早晨的首次中段尿应在禁食至少8小时后进行采集。饮酒会影响尿液代谢产物的浓度。这一点需要规范化。尿液是在不同时间采集还是在24小时内采集需进行明确规定。操作指令的任何变化均应得到验证。禁食后进行的尿液代谢组学分析可同步反应供体的类似代谢状况。研究或专门的分析测试可能需要不同的患者状况。
根据分析前准备步骤和分析测试的要求,应采集足够量的尿液。
任何影响标本采集的临床程序均应记录在案。采集的总量也应记录。
5.1.1.4.2 尿液标本及尿液采集地点贮存要求的信息
由于尿液采集后代谢谱可能发生变化,从而影响分析测试结果的有效性和可靠性,因此尿液标本上的记录信息应包括尿液采集的时间和日期。
尿液标本应在2℃至8℃下冷藏最多2h,且在离心和/或过滤之前不得冷冻,以避免形成冰晶使细胞破裂,除非分析检测中另有规定 。
允许的尿液标本总存储时间包括在收集尿液、运输到测试实验室以及在测试实验室或其他机构进一步存储的时间。
5.1.2运输要求
运输过程中,样品应保持低温(温度范围为2℃至8℃)。
应采取适当措施以确保温度始终满足要求并减少标本传送时间。这些活动应在标本采集后2小时内完成。
应记录运输程序要求的符合性。与要求的任何偏离都应予以描述和记录。
应遵循世界卫生组织《传染性物质和诊断标本安全运输指南》 [14]。
尿液标本的接收时间和情况(如标签、运输条件、体积、泄漏和沉淀)应予以记录。标签、运输条件、尿液体积与尿液采集或样本制备要求中不一致的地方也应予以记录。
如果运输条件、总贮存和运输时间或尿量不满足要求,可能影响分析检测结果的有效性和可靠性[7] [8] [9],则应重新获取标本。
如果分析检测需要,应评估标本的特性(如pH值、肌酐浓度、血液和/或细菌污染情况)。
从接收样品和处理尿样之间的贮存温度和时间间隔应当予以记录。
贮存温度应符合5.1.1.4.2的规定。
尿液标本的总贮存时间应包括在尿液采集地点的贮存时间(见5.1.1.4.2),到实验室的运输时间(见5.1.2)以及在实验室或其他机构的进一步贮存时间。
一些检验需要特殊的尿液贮存/库存条件。制造商/提供者的说明应当予以遵循。应采取适当措施以确保满足推荐的温度要求。
5.2.3 尿液样品处理
先离心(推荐:2℃至8℃,1000 g~3000 g离心5分钟),然后过滤(如使用0.20μm过滤器)以去除颗粒物和细胞。
也可以只进行过滤。做好记录。
过滤器的材料和装置应证明既不吸收也不释放代谢物或干扰其分析。
注:上述离心/过滤需避免细胞破坏并导致标本被污染[7] [8] [9]。
采用替代处理程序的话,应先得到验证。
样品接收、样品处理和处理后样品的冷冻等步骤之间的温度和持续时间应予以记录。
如果处理后的样品打算冷冻保存,则应验证其对代谢组学分析的影响。应将经过处理的样品等分保存到冻存瓶中,装入体积应能满足代谢谱测试所需。等分样品的最小体积由分析检测需求来确定。应检测样品瓶性质以避免样品污染(如邻苯二甲酸盐带来的污染)。
冷冻之前,应按照5.2.3的要求除去细胞。可采用缓慢的程序性的冷却来进行控制速率的冷冻处理。
如果严格遵守离心/过滤程序(参见5.2.3要求),则在-70℃下贮存应该足以确保代谢组的NMR可检测部分至少稳定5年[9]。
对于基于MS的代谢组学,如果无法常规测量代谢产物,则在没有具体建议的情况下,建议低于-130℃的温度贮存以确保更长的稳定性[15]。对于特定的代谢物,应检查其长期稳定性。
5.2.5 尿液复融
建议在冰上复融。复融时间、复融后直至分析前的时间应予以记录。
复融程序和复融后直到开始进行后续分析前的持续时间需是经过验证确认的。
六、血液
6.1.1.1 总则
对于标本采集,拟实施的分子检验的需求(如疾病状态、标本大小)应予以考虑。
可参见ISO 15189要求。
6.1.1.2 标本供体/患者信息
记录应包括标本供体/患者的身份证明,可以用代码表示。
记录应包括但不限于下述信息:
a) 尿液供体的健康状况和相关的生活方式因素(例如健康、疾病类型、伴随疾病);
b) 人口特征(例如年龄,性别);
c) 药物治疗和尿液采集前任何治疗的信息(如麻醉剂、药物、诊断程序);
d) 采集时间,包括有关禁食、先前活动等信息;
e) 标本供体/患者的适当同意。
6.1.1.3 采血管的选择
应选择允许抽取足够量静脉血的采血管。采血管的大小取决于执行分析前和分析程序所需的静脉血量。
适用于采集血浆或采集血清的特定试管的选择则取决于后续代谢谱分析的要求。
对于血浆,可以选择EDTA、氟化钠或柠檬酸钠用作抗凝剂。EDTA是基于NMR的代谢组学以及大多数MS研究的首选方法[2] [7] [9]。在基于NMR的代谢组学中,使用肝素管会带来问题。在做NMR谱时,尽管肝素并未明显改变NMR,但肝素信号可能会使其他共振分析复杂化,包括来自脂蛋白亚类的共振。同样对于MS,用于采样的抗凝剂应不妨碍随后的分析。使用高分子量的分子(如肝素)则可能会干扰测量。
常用的采样管还可以包含其他添加剂,例如用于血清的凝块活化剂,或有利于将血浆/血清与细胞成分进行分离的聚合物凝胶(隔离胶)。
抗凝剂和任何其他添加剂的使用均应做好记录,因为它们的存在可能会干扰测量(示例参见附件A)[9] [16]。
6.1.1.4 标本供体的血液采集
对于从患者采集血样进行代谢组研究,应满足下列要求。
a) 按 ISO 15189 要求记录采样时间
b) 对于采血管的标签(标本识别),应使用常规程序(可参见 ISO 15189)或带有附加信息的程序(如二维码)。
c) 采血前应禁食至少 8 小时。在不同或非禁食条件下采血时,应制定要求并做好记录。
d) 应使用标准的静脉穿刺技术。注意采取必要的措施防止可能的反流。应当遵循制造商提供的采血管使用说明。在特定情况下,不同的技术可能也是合适的。
e) 采血管应按照制造商的说明进行采血,并应注意在抽血过程中采血管的正确位置以及所需的容积。
f) 应遵循采血管制造商的说明,在采血后立即混合或倒置试管。
g) 采血管应被证明既不吸收也不释放代谢物,也不干扰它们的分析。
注:若不将添加剂与血样混合均匀,则可能会发生影响代谢谱的情况,从而影响分析检测结果的有效性和可靠性。
6.1.1.5 血液标本的预处理
血液标本的记录应包括采血时间。
血液标本的处理(见6.2.2)应在采集后30分钟内开始(如果样本保存在室温下)[9]。如果采集管的供应商指定了其他时间,则应记录该时间。
如果分析对象是特定代谢物,则处理方式经过验证有效,则也可以在更长时间范围内操作。
样品预处理的所有步骤均应作好记录且验证有效。
6.1.2 预处理过的样本运输至实验室
如果在采血点未处理原始血样,则应按照(6.1.1.5)的规定对血液标本进行运输和确认。
气动输送系统的使用应经过确认,因为它会因高加速/减速力而影响标本质量[17]。
应采取适当措施以确保满足推荐的温度要求,并尽量缩短标本传送时长。
6.2.1 标本接收
血液标本的接收时间和情况(如标签、运输条件、体积、泄漏/破碎管)应予以记录。标签、运输条件、血液体积与血液采集或标本制备要求中不一致的地方也应予以记录。
如果运输条件、总贮存和运输时间或血量不满足要求,可能影响分析检测结果的有效性和可靠性[7] [8] [9],则应重新获取标本。
6.2.2 样品处理
处理应在采血后30分钟内(室温)开始(参见6.1.1.5)。血清和血浆应根据规定的标准程序进行制备。为去除所有循环细胞污染物,可使用特定程序进行血浆制备。
注1:这种方法的一个例子是两步离心法。第二次离心通常是超速离心。
采用的规定程序的影响应进行研究并进行确认。
注2:超离心的应用,会造成如脂蛋白谱显著改变之类的变化,从而显着影响NMR代谢组学之类的结果。
对于血清,处理时间从血液凝固开始,在室温下血液凝固一般需要约30分钟,凝固之后才可进行离心操作。如果血液凝固出现问题,则应加注说明。
如果打算将加工过的样品冷冻保存(参见6.2.4),则应将其等分到冻存瓶中,装入体积应能满足代谢谱测试所需。等分样品的最小体积由分析检测需求来确定。应检测样品瓶的性质以避免样品污染(如邻苯二甲酸盐带来的污染)。
6.2.3 预处理过的样本运输至代谢组学分析实验室或生物库
如果将样品运输到实验室后立即开展分析,则事先应验证运输条件。
如果适用,标本应在冷冻状态下进出生物库(见6.2.4)。
接收后,记录接收的血清或血浆到达时间和情况(如标签、运输条件、样品体积、泄漏情况)。发现标签、运输条件、样品体积与采集管所描述不符,以及测定的任何变化,均应做好记录。
如果存在运输条件、总贮存和运输时间或其他可能影响分析检测结果有效性和可靠性的不合格之处,则应尽可能获取一个新样品。
应遵循世界卫生组织《传染性物质和诊断标本安全运输指南》 [14]。
6.2.4 长期贮存要求
样品接收、样品处理和处理后样品的冷冻等步骤之间的温度和持续时间应予以记录。
可以应用控制速率的冷冻。
如果严格遵守离心程序(参见6.2.2),则在-70℃下贮存应足以确保代谢组的NMR可检测部分至少稳定5年[9]。
对于基于MS的代谢组学,如果无法常规测量代谢产物,则在没有具体建议的情况下,建议低于-130℃的温度以确保更长的稳定性[16]。对于特定的代谢物,应检查其长期稳定性。
6.2.5 血清和血浆复融和使用
为了进行分析测试,应将样品复融。建议在冰上复融。复融程序及从复融至开始进行后续分析前的时长应得到验证确认。
附录 A(规范性)代谢组的不稳定性
据文献可知,离体生物体液的代谢组稳定性有两个主要的关键方面:
a) 由于细胞的存在而引起的采集后改变,主要与酶促反应有关。
b) 在小分子和溶解氧的复杂混合物中发生的化学反应,导致采集后的改变。
在这里,我们提供了观察到的尿液和血清/血浆中组分改变的示例,这些示例可以用作评估内部程序的工具。
a) 由于细胞的存在而引起的采集后变化。
收集了三个具有不同细胞含量的尿样(1-非常高;2-中;3低),分成2个等分试样品,其中一个(标记为R)正常进行分析,将另一个(标记为P)则在分析之前进行温和离心。细胞含量可通过对P样品进行温和预离心后的沉淀物进行目测来估算。
通过获取样品在采集后不同时间点(0h,1h,2h,4h,6h,8h)的NMR谱图(600 MHz,300 K下的1H NOESY实验),监测P和R尿液中代谢组随时间的稳定性。),最长时间点为20h至24h,用过夜(ON,overnight)表示(见图A.1)。在两次光谱采集之间的时间段,样品需在4℃保持。
与原始代谢组的偏差被计算为每个时间点获得的光谱与0时间点的光谱之间的欧几里得距离。两个光谱之间的欧几里得距离被计算为n维空间中的距离,其中n对应于每个光谱的点数。

a t:时间,以小时 h 为单位
b dE: 欧几里得距离(euclidean distance)
图A.1 不同细胞含量的样品图谱与原始代谢谱(红箭头所示 0 时间点)的偏差
样品3的曲线在P和R尿液中都非常稳定。相反,样品2-R和1-R的轮廓与P对应的轮廓随着时间的推移逐渐变得不稳定。这些数据表明,使用温和的离心和/或过滤去除新鲜尿液中的细胞可确保样品的一致性和稳定性。该处理步骤的重要性取决于每个样品中的细胞含量,每个患者的细胞含量都不同。细胞数越高,观察到的变化程度越大。应避免在去除细胞之前冻结,以防止细胞破裂和释放细胞内内容物。
b) 样品采集后由于化学反应而发生的变化。
跟踪预处理后尿液中代谢组的稳定性24小时,每2小时获取一次NMR谱图。在两次数据采集之间时间段,样品需在4℃保持。在预处理(0小时,1小时,2小时,4小时,6小时,8小时)之后的不同时间点以600MHz,300K记录1HNOESY实验,最长时间点为20h至24h,以过夜(ON,overnight)表示。

a 蓝线:t = 0 h;
b 绿线:t = 1 h;
c 红线:t = 2h;m = 1。
d 橙线:t = 4 小时;m = 1。
e 暗红线:t = 6 h;
f 紫线:t = 8 h;
g 青线:t = ON(过夜);
h a 琥珀酸盐。
i b 丙酮酸。
j c 醋酸纤维。
k d 抗坏血酸。
l e 肌酸。
m δ1H:质子化学位移,以 Hz / MHz 为单位(此处以 Hz / MHz 表示的化学位移,通常称为 ppm。)
注:箭头指示随时间变化的方向。
图A.2 尿液样品中与处理阶段无关的影响
代谢谱有许多改变是由于细胞存在以外的因素而发生,并且可以归因于(酶促或非酶促的)氧化还原反应。琥珀酸、丙酮酸、乙酸盐、抗坏血酸和肌酸是受影响最大的代谢产物之一(见图A.2)。为了保持最敏感的代谢物水平,样品在处理前应始终放在冰上,并立即在-80℃下冷冻。由于反复冻融可观察到类似的改变,因此应避免。
a) 由于细胞的存在而引起的采集后改变。
从5位健康供体中收集血浆-EDTA样品。对于每个供体,在6个时间点(0小时、6小时、24小时、48小时、72小时和144小时)处理样品。在处理之前,将样品保持在室温下。处理后的样品立即冷冻并在分析前解冻。进行600 MHz,310 K的1H NOESY实验。代谢物水平的变化是通过对代表性的1H NMR信号进行积分来确定的。
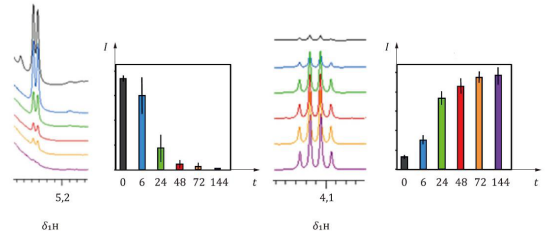
a t 时间,以小时为单位
b I 相对强度(任意单位)
c δ1H 质子化学位移,以 Hz / MHz 为单位
图A.3 血浆样品预处理后葡萄糖(左图)和乳酸(右图)水平的变化
在血液采集和处理之间,整体代谢组学谱会发生几种代谢物浓度的变化。最显著的变化包括葡萄糖的减少和乳酸的增加(见图A.3),这主要归因于红细胞的作用。因此,尽快处理样品至关重要。
b) 样品采集后由于化学反应而发生的改变。
追踪血清代谢组的稳定性12 h,每4 h(0h、4h、8h、12h)获取NMR光谱。在两次数据采集之间将样品保持在4℃。在600 MHz,310 K条件下进行1H NOESY实验。
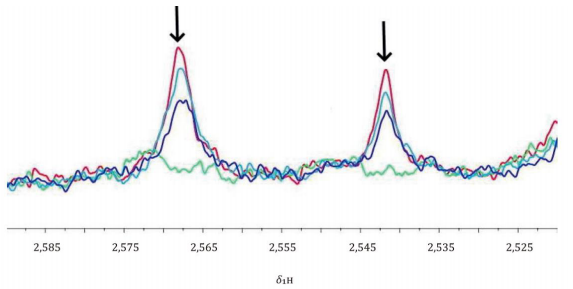
a 红色迹线:0 h;
b 青色迹线:4 h;
c 紫色迹线:8 h;
d 绿色迹线:12 h;
e δ1H 质子化学位移,单位为 Hz / MHz
注:箭头表示随时间变化的方向。
图A.4 血清样品处理后柠檬酸根水平的变化
选择合适的采集管会影响下游分析测量的结果。例如,真空管可以包含添加剂,例如抗凝剂(EDTA,柠檬酸钠,肝素)或聚合物凝胶(凝胶分离器),可促进血浆/血清与细胞成分的分离。就分析结果而言,它们的存在不是“中立的”。
例如,对以柠檬酸钠为抗凝剂、以多糖为细胞分离剂的血浆样品和装有抗凝剂和细胞分离基质的市售试管中添加有血浆常规分析用缓冲液的空白样品,均获取1H NOESY光谱(600 MHz,310 K)(见图A.5)。

a 上部绿线:柠檬酸钠,Ficoll™Hypaque™溶液中的血浆样品,在磷酸盐 NMR 缓冲液中
b 底部黑线:磷酸盐 NMR 缓冲液已添加到柠檬酸盐 Ficoll™Hypaque™溶液管中
c δ1H :质子化学位移,以 Hz / MHz 为单位
图A.5 在血浆柠檬酸盐,Ficoll™Hypaque™溶液上获得的 1H NMR 光谱1)
这表明应避免使用分离介质来采集血浆,因为它会引入许多新的光谱信号,其中一些信号非常强烈且具有不同的线宽,因此严重降低了活性谱面积和可用于后续分析的代谢物的数量。在实践中,由于添加剂的强信号的掩盖,会使得几乎30%的有效光谱区域变得无用。因此需要使用适当的采集管,以避免其干扰分析方法。不同采集管的可行性应参照所选的分析平台进行检查。
在整个分析前工作流程中使用的塑料也会将污染物释放到样品中。通常,所有材料在使用前均应经过验证。
始终运行一些在工作流程中使用物料的空白样本。
参考文献:
[1] WISHART DSFEUNANG YD, MARCU A, GUO AC, LIANG K, VÁZQUEZ-FRESNO R, et al. , HMDB 4.0: The human metabolome database for 2018. Nucleic Acids Res. 2018, 46 pp. D608–D617
[2] Dona A.C., Jiménez B., Schäfer H., Humpfer E., Spraul M., Lewis M.R. et al. , Precision high-throughput proton NMR spectroscopy of human urine, serum, and plasma for large-scale metabolic phenotyping. Anal. Chem. 2014, 86 pp. 9887–9894
[3] Vignoli A, Ghini V, Meoni G, Licari CTAKIS PG, TENORI L, ET AL. , High-throughput metabolomics by 1D NMR. Angew. Chem. Int. Ed. Engl. 2019, 58 pp. 968–994
[4] Dettmer K., ARONOV PA, HAMMOCK BD. Mass spectrometry-based metabolomics. Mass Spectrom. Rev. 2007, 26 pp. 51–78
[5] Ceglarek U., Dittrich J., Helmschrodt C., Wagner K., Nofer J.-R.ET AL. , Preanalytical standardization of sphingosine-1-phosphate, sphinganine-1-phosphate and sphingosine analysis in human plasma by liquid chromatography–tandem mass spectrometry. Clin. Chim. Acta. 2014, 435 pp. 1–6
[6] Helmschrodt C., Becker S., Thiery J., Ceglarek U., Preanalytical standardization for reactive oxygen species derived oxysterol analysis in human plasma by liquid chromatography–tandem mass spectrometry. Biochem. Biophys. Res. Commun. 2014, 446 pp. 726–730
[7] Bernini P., Bertini I., Luchinat C., Nincheri P., Staderini S., Turano P., Standard operating procedures for pre-analytical handling of blood and urine for metabolomics studies and biobanks. J. Biomol. NMR. 2011, 49 pp. 231–243
[8] Emwas A.-H., Luchinat C., Turano P., Tenori L., Roy R., Salek R.M.ET AL. , Standardizing the experimental conditions for using urine in NMR-based metabolomic studies with a paticular focus on diagnostic studies: a review. Metabolomics. 2015, 11 pp. 872–894
[9] Ghini V., Quaglio D., Luchinat C., Turano P., NMR for sample quality assessment in
metabolomics. New Biotechnol. 2019, 52 pp. 25–34
[10] Kamlage BMALDONADO SG, BETHAN B, PETER E, SCHMITZ O, LIEBENBERG V, ET AL. , Quality Markers Addressing Preanalytical Variations of Blood and Plasma Processing Identified by Broad and Targeted Metabolite Profiling. Clin. Chem. 2014, 60 pp. 399–412
[11] Kamlage B., Neuber S., Bethan B., González Maldonado S., Wagner-Golbs A., Peter E.ET
AL. , Impact of Prolonged Blood Incubation and Extended Serum Storage at Room Temperature on the Human Serum Metabolome. Metabolites. 2018, 8 p. E6
[12] ISO/IEC 17020, Conformity assessment — Requirements for the operation of various
types of bodies performing inspection
[13] ISO 14971, Medical devices — Application of risk management to medical devices
[14] WHO Guidelines for the Safe Transport of Infectious Substances and Diagnostic Specimens https:// www .who .int/ csr/ emc97 _3 .pdf
[15] Hubel A, Spindler R., Skubitz A.P.N., Storage of human biospecimens: selection of the optimal storage temperature. Biopreservation and biobanking 2014, 12, pp. 165-175.
[16] Ghini V., Unger F.T., Tenori L., Turano P., Juhl H., DAVID KA Metabolomics profiling of pre-and post-anesthesia plasma samples of colorectal patients obtained via Ficoll separation. Metabolomics. 2016, 11 pp. 1769–1778
[17] Streichert T., Otto B., Schnabel C., Nordholt G.ET AL. , Determination of hemolysis thresholds by the use of data loggers in pneumatic tube systems. Clin. Chem. 2011, 57 pp. 1390–1397
添加小趣微信,获取全文PDF文件。

百趣生物
热文推荐


点击关注阿趣代谢公众号

线上直播@阿趣空中课堂

长按关注微信视频号

点击查看百趣生物官网
免责声明:本公众号的原创文章相关知识产权归百趣生物所有,如需转载或引用文中内容(包括但不限于文字、图片等)请后台留言联系编者,获得授权后方可发布,未经授权严禁私自转载、删减、洗稿。本公众号的转载文章和观点仅代表原作者个人观点,不代表百趣生物立场,所有内容仅供行业学习交流,不构成任何建议,无商业用途。我们尊重原创和版权,如有疏忽误引用您的版权内容,请及时联系我们处理!
-
仪器推荐
-
仪器推荐

-
仪器推荐
-
仪器推荐

-
仪器推荐
-
微信文章
-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章