Cells|看这篇就够了:一文了解肠道微生物代谢与炎症性肠病

●
●发表期刊:Cells
●影响因子:6.6
●发表时间:2019.05
越来越多的证据表明,饮食和代谢产物,通过调节代谢、免疫系统和炎症来影响宿主的病理生理过程。自身免疫性疾病如炎症性肠病(IBD)与宿主对饮食反应的调节有关。微生物群影响宿主的一个关键机制是通过G蛋白偶联受体(GPCRs)传递信号,称为代谢物传感GPCRs。在肠道中,免疫和非免疫细胞都表达GPCRs,它们的激活通常通过调节免疫系统功能和上皮完整性提供抗炎信号完成。GPCR家族的成员在微生物群、免疫系统和肠上皮细胞之间起着纽带作用,所有这些成分参与维持肠道稳态。受损的GPCR信号与IBD和其他疾病相关,包括肝脂肪变性、糖尿病、心血管疾病和哮喘。
在这篇综述中,我们首先概述了几组代谢物传感GPCRs的信号传导、功能、表达和生理作用。然后,我们讨论了它们在炎症调节中的作用,它们现有的内源性和合成配体以及治疗炎症性肠病的创新方法的最新发现。
研究结果
1.饮食是IBD的一个危险因素
工业化国家的IBD发病率正在上升。饮食、卫生状况、抗生素使用、微生物暴露和污染等因素都与IBD的发展有关。饮食是可能将工业化和西方生活方式与IBD发病率增加联系起来的潜在环境因素之一。许多大型前瞻性队列研究试图确定导致IBD风险的饮食模式。护士健康研究(NHS)显示,摄入大量纤维(主要是水果)的人不容易患CD。这些队列的研究结果显示,镉的风险与钾和锌的摄入呈负相关。此外,NHS表明,高ω-3(n-3)与ω-6(n-6)多不饱和脂肪酸(PUFA)比率的高消费对UC的发展具有保护作用。同样,欧洲癌症和营养调查研究表明,食用大量红肉(含有高浓度的亚油酸(一种n-6PUFA))的个人,UC的发病率更高。
2.饮食调节肠道微生物群及其代谢物
越来越多的证据表明,饮食影响肠道微生物群的组成和微生物群落产生的代谢物。与配方奶粉喂养的婴儿相比,母乳喂养的婴儿更早形成了不同的肠道微生物群。在成人中,饮食模式被认为可以改变肠道微生物群的组成。肠道微生物群的主要变化与饮食变化有关,表明饮食在形成细菌组成中起主导作用。在IBD患者中,肠道菌群发生失调。高脂肪和低纤维饮食可导致健康志愿者的生态失调。富含纤维的素食可抑制人体内潜在致病细菌(如大肠杆菌)的生长,这是由SCFA的产生介导的,可降低肠道pH值。在小鼠中,与肠道微生物群变化相关的饮食血红素铁诱导氧化应激介导的结肠上皮损伤。对识别微生物来源代谢物的受体的更深入了解可能有助于确定导致IBD的因素。
3.GPCRs感知微生物来源的代谢物
GPCRs可以结合来自食物的代谢物。这些代谢物要么通过直接的宿主代谢产生,要么通过消化产生,如MCFAs(来源于椰子、棕榈仁和牛奶)、LCFAs(来源于橄榄油和鱼)、烟酸和犬尿烯酸(宿主色氨酸代谢的中间产物),或者通过肠道细菌发酵后的次级代谢物产生,例如,SCFAs和吲哚-3-醛。SCFAs主要在结肠中由未消化的碳水化合物产生。蛋白质发酵也可能有助于SCFAs的产生。SCFAs通过单羧酸转运蛋白1(MCT1)和钠偶联单羧酸转运蛋白1(SMCT1)穿过上皮细胞的细胞膜进入宿主。MCFAs主要被肝脏用作能量来源。肠细胞吸收LCFAs并将LCFAs酯化成复合脂质,作为细胞膜的组成部分、代谢燃料、脂质介质的前体、离子通道的调节剂和基因表达的调节剂。来源于宿主和微生物群代谢的色氨酸代谢物与代谢物传感GPCRs结合。色氨酸是蛋白质生物合成必需的氨基酸。此外,色氨酸是血清素的前体,血清素是一种在肠道和大脑中合成的重要神经递质。肝脏通过降解过量的色氨酸来调节色氨酸代谢。在肠道中,已知色氨酸代谢物如犬尿氨酸、吲哚-3-醛和吲哚-3-乙酸通过作用于适应性免疫和肠道屏障来调节炎症。
4.代谢物和粘膜炎症
细菌代谢物在肠道中有积极益处(图1)。
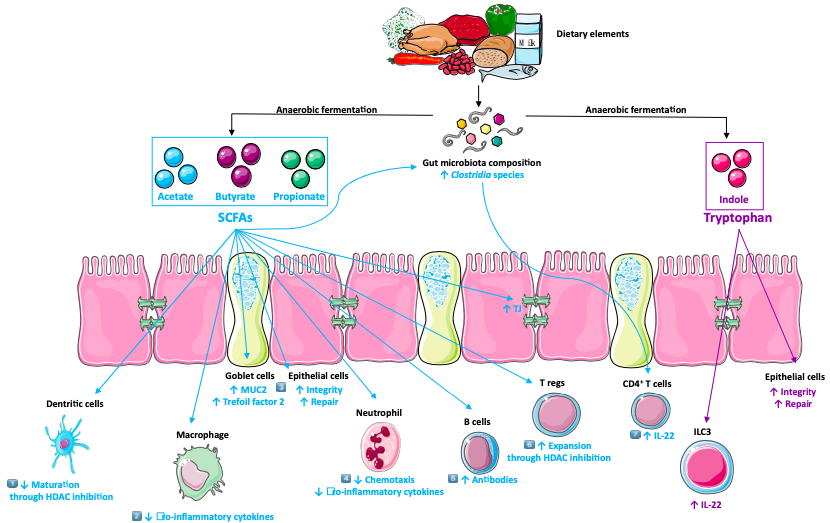
图1
4.1 短链脂肪酸
与健康受试者相比,IBD患者的SCFAs水平较低,产生SCFAs的细菌(拟杆菌门和厚壁菌门)数量减少,此外,两种SCFAs转运蛋白(MCT1和SMCT1)也减少了。施用SCFAs降低了人类结肠炎的严重程度。
4.2 色氨酸代谢物
给结肠炎的鼠模型补充色氨酸和色氨酸代谢物可减少结肠炎的症状[。相反,喂食色氨酸缺乏饮食的小鼠更容易患结肠炎。与健康对照组相比,IBD患者的血清色氨酸水平较低。此外,吲哚胺2,3双加氧酶-1(犬尿氨酸途径的第一步)的mRNA表达水平在人和鼠结肠组织中上调。微生物使用色氨酸作为能源来产生芳香烃受体(AhR)的配体,这是维持上皮屏障和上皮内淋巴细胞(IELs)正常功能所必需的。AhR缺失会加重小鼠的肠道炎症。
5.代谢物敏感G蛋白偶联受体
在细胞外,代谢物可以作为几种代谢物传感GPCRs的激动剂。这些受体构成了哺乳动物中最丰富的膜蛋白家族。多项研究指出了这些受体在维持生理功能中的重要性。当配体与代谢物传感GPCRs结合时,会引起构象变化。因此,受体可以激活相关的G蛋白。然后,G蛋白α亚单位可以与β和γ亚单位分离,进一步直接触发细胞内信号蛋白或靶功能蛋白,这取决于α亚单位类型(Gαs,Gαi/o, Gαq/11, andGα12/13)和β抑制蛋白,包括环磷酸腺苷(cAMP)、磷脂酶c-β和RhoGEFs。
此外,这些受体调节下游信号通路,包括不同的激酶级联,如ERK/MAPK,JNK, p38或Akt/PI3K,以控制细胞增殖、分化、存活和迁移。
5.1 短链脂肪酸(SCFAs)的GPCRs
GPR41:GPR41主要由丙酸盐、乙酸盐、己酸盐、丁酸盐和戊酸盐激活,但激活程度较低。这种受体的激活导致细胞内Ca2+释放和cAMP减少。
GPR43:乙酸盐和丙酸盐是肠道厌氧菌的发酵产物,两者对GPR43的亲和力相等。GPR43的体外激活诱导细胞内Ca2+的释放,并减少结肠上皮中的cAMP。人类中性粒细胞、巨噬细胞、树突细胞、肠上皮细胞表达GPR43。GPR43信号下调炎症反应。GPR43还抑制脂肪组织中胰岛素介导的脂肪积累。此外,GPR43的缺乏会损害β细胞增殖,导致葡萄糖耐量降低和胰岛素分泌受损。
GPR109A和GPR109B:虽然烟酸被确定为第一个GPR109A激动剂,但后来的研究表明,在丁酸盐水平足够高的肠道中,丁酸盐可能与该受体更具生物学相关性。GPR109A可在巨噬细胞、中性粒细胞和脂肪细胞上检测到。此外,在小鼠中,GPR109A在小肠和大肠中表达,广泛存在于脾和骨髓中。烟酸对GPR109A的激活减少了巨噬细胞、单核细胞和上皮细胞对促炎细胞因子的分泌。在缺乏GPR190A的小鼠中,烟酸诱导的游离脂肪酸和甘油三酯血浆水平的降低被消除,这表明GPR190A介导了烟酸在体内的抗脂肪分解和降脂作用。尽管GPR109B和GPR109A具有高度同源性,但GPR109B和GPR109A不具有相同的配体烟酸。
5.2 中长链脂肪酸的GPCRs(MCFA,LCFA)
GPR40:链长为C8–C22的饱和和不饱和脂肪酸激活GPR40,其主要在胰腺和肝脏中表达。此外,免疫细胞、味蕾和中枢神经系统也表达GPR40。GPR40的激活在胰岛素分泌的调节中起重要作用。
GPR120:GPR120与GPR40具有10%的氨基酸同源性,被鉴定为ω-3脂肪酸的受体,但在体外,ω-6脂肪酸也可以结合该受体。Hirasawa等人表明,FFAs对GPR120的激活导致细胞内Ca2+的升高和ERK级联的激活,这表明了与G蛋白的Gαq家族的相互作用。
GPR84:链长为9-14个碳的MCFAs专门与这种受体结合。GPR84受体由脂肪组织和各种白细胞表达,特别是巨噬细胞和嗜中性粒细胞,在炎症条件时GPR84表达量增加。
5.3 氨基酸和相关代谢物的GPCRs
GPR35:GPR35是一种特征不明显的GPCR,在胃肠道中表达,例如在胃、小肠和结肠的肠上皮细胞、树突状细胞和巨噬细胞中表达。GPR35的内源性配体候选物包括犬尿烯酸和2-油酰溶血磷脂酸,而pamoicacid、zaprinast和YE120是合成的GPR35激动剂。此外,CXCL17,一种对肺泡巨噬细胞归巢至关重要的趋化因子,也被认为是GPR35的配体。然而,另一项研究表明,CXCL17既不激活GPR35信号,也不诱导GPR35表达细胞的趋化性。
5.4 胆汁酸传感GPCRs
GPR131:GPR131也称为TGR5,发现于2002年,它在免疫细胞(单核细胞和巨噬细胞)、肌肉、脊髓、脂肪细胞和肠神经系统中高度表达。这种受体与肠道巨噬细胞和单核细胞特别相关,因为它可以识别初级和次级胆汁酸。作为次级胆汁酸,石胆酸和牛磺胆酸是TGR5最有效的配体。在鼠巨噬细胞中,TGR5的特异性缺失导致胰岛素抵抗。此外,TGR5的基因敲除加重了DSS和TNBS诱导的肠道炎症。
5.5 pH敏感受体
GPR65:细胞外酸性条件下质子与GPR65结合,并作为酸性代谢物的替代受体,如SCFAs,然而,没有证据证实这一假设。GPR65在多种免疫细胞上表达,包括T和B淋巴细胞、中性粒细胞,但在嗜酸性粒细胞和肥大细胞上表达异常高。GWAS研究发现GPR65的单核苷酸多态性与IBD易感性增加相关。多项证据表明GPR65具有细胞保护作用,因为酸性条件下嗜酸性粒细胞活性的增加与GPR65的激活有关。此外,BCL2的表达与慢性淋巴白血病细胞中GPR65的表达相关。
5.6.柠檬酸循环中间体的GPCRs
GPR91;GPR91受体被与Gi型G蛋白偶联的琥珀酸激活。肝脏、心脏、脂肪组织、肠、脾和免疫细胞,包括树突状细胞表达GPR91。GPR91可能在肾血管性高血压中起作用。
GPR31:巨噬细胞中表达的GPR31已被确定为12(S)-羟基二十碳四烯酸的靶受体。GPR31在炎症和肿瘤进展中起着至关重要的作用。
6.代谢物传感GPCRs与炎症性肠病
无菌小鼠表明了共生生物在功能性免疫系统发育中的重要性。然而,肠道菌群塑造免疫系统的确切分子机制仍有待探索。越来越多的证据表明,细菌来源的代谢物通过代谢物传感GPCRs在免疫系统的发育中发挥关键作用。
代谢性GPCRs存在于肠道的免疫、间充质和上皮细胞中。GWAS研究已经建立了IBD和代谢物传感-GPCRs之间的联系,GPR35和GPR65被认为是IBD风险基因。
7.代谢物传感GPCRs在肠道中发挥抗炎作用的可能机制
图2显示了代谢物传感GPCRs如何影响IBD的一般模型。
代谢传感GPCRs维持肠道稳态的主要两种抗炎机制包括:(1)调节肠道上皮细胞和(2)促进先天和适应性肠道免疫。
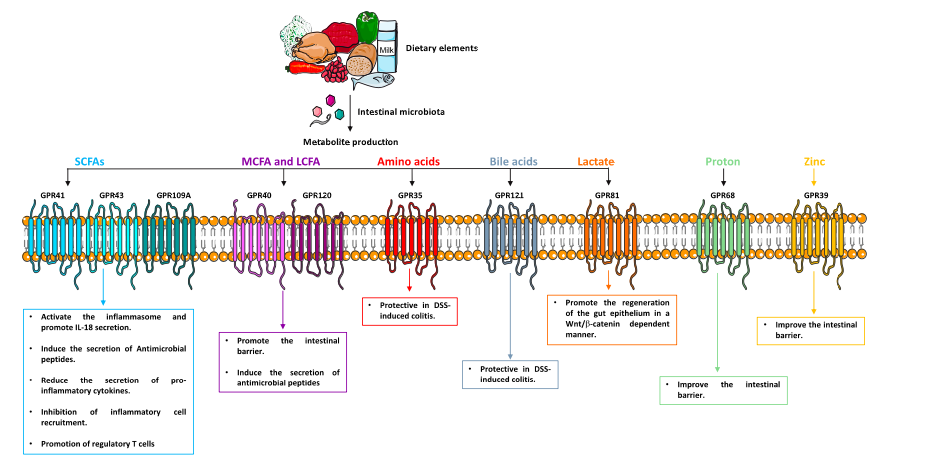
图2
8.在IBD背景下研究饮食和细菌来源代谢物的潜在工具
多样化的肠道菌群有助于建立更稳定的宿主系统,但这种多样性导致了一个复杂的系统,这对旨在研究与特定物种相关的特定代谢物的科学家来说是一个劣势。小鼠与确定的微生物群的定植调节宿主的免疫系统,这也影响微生物群的建立和繁殖。一些最强大的研究工具是无菌和无菌的小鼠,其可以通过消除来自其他肠道微生物组的背景信号来研究特定菌株和宿主之间的相互作用。
9.代谢物传感GPCRs在IBD治疗中面临哪些挑战
代谢物传感GPCRs的研究面临许多挑战。在这方面,细菌的代谢物,如丁酸,可以通过抑制HDAC或通过代谢物传感GPCRs发挥抗炎作用。此外,代谢物传感GPCRs也通过β-arrestin-2发出信号,β-arrestin-2通常产生抗炎作用。因此,了解细菌代谢物是否通过HDAC抑制、β-arrestin-2信号传导或通过G蛋白信号传导发挥有益作用是至关重要的。为了确定可能的IBD治疗方法,需要进一步研究这些不同的途径。
代谢物传感GPCRsGPR41、GPR43和GPR109A可以高亲和力识别不同的细菌代谢物(如丁酸),同一配体可以与不同的GPCRs结合,表明在该体系中存在冗余。此外,SCFAs还可以改变局部的pH值,并可能在激活主要的GPCRs的同时激活pH感知的GPCRs。需要进一步的研究来解剖这个高度冗余的系统。
一些代谢物传感GPCRs广泛而多样的系统性表达模式和功能是另一个具有挑战性的方面。
研究结论
代谢物传感GPCRs成为开发新治疗工具的有利靶点。这些代谢物传感受体大部分在肠道中表达。最近备受瞩目的出版物指出了它们在调节肠道炎症方面的重要性。深入了解饮食和代谢物,包括细菌和宿主来源的代谢物及其GPCRs如何影响肠道内环境平衡,无疑将对阐明饮食、微生物组和IBD之间的联系具有重要意义,从而开发出预防和治疗炎症性肠病的新方法。

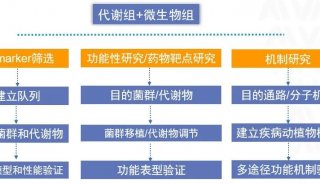
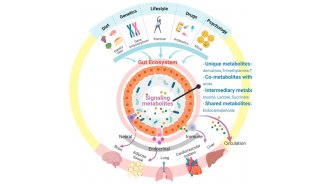
人体肠道内寄生的细菌数目约40万亿个,微生物基因组总数目大约是人体基因组数目的150倍。因此,肠道菌群也被称作人体的“第二基因组”,“第二大脑”,“肠脑”。肠道微生物与宿主的代谢、免疫、神经系统等多种调控机制有密切的联系。通过代谢组学研究可发现肠道微生物随宿主生理病理变化的关键代谢物,代谢组联合微生物组学分析,可以为肠道微生物组-宿主间互作机制研究提供线索,为个性化医疗的开发提供直接依据。
迈维代谢可提供多种肠道菌群相关的靶向代谢组学检测技术服务和高通量代谢组学检测,以及肠道微生物研究必不可少的微生物组学测序服务,对于多组学研究客户免费提供微生物+代谢组联合分析服务。
99%的代谢组学研究者都在阅读下文:
●项目文章 | 喜讯!nature发表江西农大黄路生院士团队宿主基因影响肠道菌群成果
●项目文章 | 能量代谢和全谱代谢组学助力新华医院皮肤科团队发现了一种新的疾病——CAOP综合征

客服微信:metware888
咨询电话:027-62433042
邮箱:support@metware.cn
网址:www.metware.cn
我就知道你“在看”