Nat Rev Drug Discov | 一文了解蛋白组学与药物发现
景杰生物 | 报道
蛋白质是大多数药物的主要靶点。基于质谱的蛋白质组学技术的快速发展,能够以更高维度对疾病表型及其调控机制进行剖析。近日,国际顶级期刊Nature Reviews Drug Discovery (IF=84.694) 发表了题为The emerging role of mass spectrometry-based proteomics in drug discovery 的重磅综述,总结了基于质谱的蛋白质组学、蛋白质修饰组学方法在早期药物发现,例如药物靶点发现和验证,以及药物安全性评估等领域的新兴应用。

1前言:蛋白质组学与药物发现
寻找药物靶点和探究生物活性化合物在相关疾病模型中的作用是药物研发的重要过程。在历史数据来看,大多数药物都是通过在疾病模型中,针对生物活性化合物的生物反应进行筛选而发现的。这种基于表型的筛选策略不涉及“药物靶点”,但更进一步的研究,则必须要对生物活性化合物的靶点进行识别,以了解靶点相关的安全风险、对靶点效应进行优先排序、并进行先导药物的持续优化。
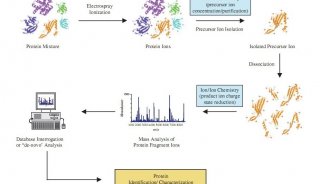
蛋白质是生命活动的主要承载者,大多数药物的作用靶点是蛋白质。因此了解药物作用的蛋白质种类和其调控功能,是解决如何通过特定方式干预疾病表型的关键。蛋白质组学方法通过对与药物治疗相关的蛋白质活性及功能的定量分析,并在蛋白质组范围内对翻译后修饰 (PTM) 进行全面的功能注释,提供了特异性,且有高价值的药物发现相关信息,例如:临床药物的磷酸化情况、蛋白质的解链温度、整体蛋白质降解或主要组织相容性复合物 (MHC) 分子在细胞表面呈递的肽等。蛋白质组学技术彻底改变了药物发现的研究方式,广泛用于靶点识别,靶点验证和安全性和有效性的监测 (图1)。

图1 基于质谱的蛋白质组学在临床前药物发现过程中的应用
2鉴定药物作用靶点
化学蛋白质组学(chemical proteomics) 策略通过分析蛋白质的亲和力、活性、稳定性和折叠来研究药物在体内细胞中的作用靶点 (下图)。具体来说,基于化合物的蛋白质分析 (Compound-centric chemical proteomics,CCCP) 根据与活性化合物衍生的化学探针的结合,来识别来自细胞提取物或活细胞中的药物靶标 (下图b)。基于活性的蛋白质分析 (Activity-based protein Profiling,ABPP) 根据活性和与活性化合物的化学探针的反应性来识别蛋白质 (下图c)。一些新兴的方法利用了化合物结合对蛋白质结构和生物物理特性的影响,例如热稳定性 (热蛋白质组分析,TPP,下图d) 或对蛋白水解的抵抗力 (LIP-MS、DARTS,下图e)。

图2 蛋白质组学策略研究药物作用
3识别药物作用机制
功能蛋白质组学(Mechanism-centric proteomics) 策略通过分析蛋白质的丰度 (下图b)、修饰 (下图c)、定位 (下图d) 和相互作用 (下图e) 来研究药物作用机制 (modes of action,MOAs)。值得一提的是,由于大多数FDA批准的药物以细胞外信号蛋白为靶点,早期的蛋白质组学方法分析往往关注细胞表面受体连接(如通过受体酪氨酸激酶 (RTKs)和G蛋白偶联受体 (GPCRs))触发的信号通路,近年来细胞内蛋白 (如表观遗传酶) 也备受关注。
 图3 蛋白质组学研究药物作用机制和疾病生物学
图3 蛋白质组学研究药物作用机制和疾病生物学3.1 蛋白质丰度
蛋白质丰度的改变,表明药物对蛋白质合成/降解的直接或间接影响。蛋白组技术检测药物治疗反应中的蛋白质丰度变化,可以反映药物治疗反应中预期的复合效应或副作用效果。例如,用氟霉酮处理的心脏成纤维细胞的蛋白质组学分析显示,细胞器的蛋白组变化可以归因于脯氨酸-tRNA合成酶的抑制。
同样的,机体也有补偿机制以恢复蛋白质组稳态,从而导致耐药性。分析治疗耐药细胞的蛋白组成分变化,可能揭示耐药的潜在机制。例如,在曲妥珠单抗耐药的胃癌细胞中WNT β-catenin通路的激活表明该通路可能是一个潜在的抗耐药靶点。
此外,细胞表面受体连接和内化反应的蛋白质降解也可通过蛋白质组学检测到。例如通过蛋白组方法进一步确定了免疫调节药物 lenalidomide 处理对酪蛋白激酶1α与ikaros和aiolos转录因子的降解,这提示了新的药物研发策略,如PROTACs (proteolysis-targeting chimeras)。
3.2 蛋白 PTMs
细胞内通过蛋白质翻译后修饰 (PTMs) 来实现动态调节。因此,基于质谱的修饰组学方法,可用于监测药物诱导的信号通路变化,并识别药物激活或抑制的底物蛋白。由于癌症的耐药性通常与RTKs下游信号的代偿性有关。因此,磷酸化修饰组学常用于定义单药治疗的适应性激酶反应或评估药物治疗组合。如拉帕替尼耐药乳腺癌细胞中Src家族激酶的干扰,以及曲妥珠单抗耐药乳腺癌细胞中Src激酶和MAPKs的干扰。
除磷酸化外,乙酰化修饰、泛素化修饰等也常用于蛋白质组学方法。新型PTMs的研究,往往更有利于揭示新的细胞免疫信号检查点。例如,研究人员通过乙酰化修饰组学来监测HDAC抑制剂的选择性,证明用于治疗亚急性和慢性皮肤湿疹的bufexamac,除了抑制其既定的目标HDAC6外,还能够通过稳定缺氧诱导因子1α (HIF1α) 来触发类缺氧反应。这个观察结果可以解释药物的促炎副作用。通过泛素化分析揭示了受去泛素化修饰酶 (DUBs) 调控的蛋白质亚群,推进了对泛素c端水解酶USP7通过p53依赖的促癌作用机制的了解。
3.3 蛋白质定位
蛋白质组学能够对细胞器中的蛋白质进行全面的分析,例如细胞核或线粒体,以及细胞表面或细胞外空间的蛋白质,提供蛋白质在细胞或组织中的定位信息。对于跨多个亚细胞区隔的蛋白质空间动力学研究,分离细胞器的蛋白质组学分析和基于邻近连接的蛋白质相互作用 (PPI) 网络同样成为强大的工具。
3.4 蛋白质相互作用
阐明PPIs的经典方法是通过免疫沉淀或亲和纯化单个内源性或表位标记蛋白来捕获直接和间接的蛋白质相互作用体。通过对比没有或存在药物的情况下蛋白质复合物的成员,可实现检测化合物敏感的PPIs和探索化合物调节靶活性的机制。
4靶点发现和验证
在药物发现的早期阶段,对潜在药物靶点进行深入的分子和功能分析有助于验证药物靶点的真实性。例如多项蛋白组研究报道早期肝细胞癌中被激活的信号通路 (如抑癌因子RB1) 的过度磷酸化,这一结果后来被验证为结肠癌的驱动和治疗靶点。
值得注意的是,蛋白质组学方法在了解疾病的分子机制方面优于基因组和转录组分析。例如在乳腺癌中高度磷酸化的GPCR和PAK1、PTK2、RIPK2以及TLK2被确定为潜在靶标。在囊性纤维化中,对CFTR相互作用蛋白组的分析显示,苯丙氨酸508 (ΔF508)的缺失改变了CFTR的翻译、折叠、运输和降解,这提示了靶向疾病相关的蛋白稳定途径的策略。
在快速发展的肿瘤免疫领域,基于质谱的蛋白质组学已经成为直接、大规模表征HLA结合肽的有力技术,用于检测适用于癌症免疫治疗的新抗原。如最近一项蛋白组研究发现,CT45的表达可促进化疗后高级别严重卵巢癌患者的生存,CT45衍生的HLAI类多肽可促进患者衍生的细胞毒性T细胞对肿瘤细胞的杀伤。
5药物安全性和有效性评估
分析报告称,60%失败的化合物因临床前毒性而终止,其中40%是基于I期和II期临床试验中的安全性风险。在药物发现早期对候选药物进行二次药理学研究,评估其药物的安全性和有效性,避免靶点验证不足、有效性缺乏以及与靶点效应和脱靶效应相关的安全问题,可最大限度地减少药物开发过程中的不良反应 (ADR) 和药物后期的磨耗。
与工业分析panel (industrial assay panels) 相比,前者主要涵盖在药物发现中的既定的少数蛋白,以及在药物不良反应中具有已知作用的蛋白质,而忽略了剩余>90%的蛋白。蛋白质组学分析对样本中全部蛋白质进行无偏分析,消除了预前的限制,更适用于对整个蛋白质组的化合物脱靶的全面评估。
6小分子降解物的开发
小分子降解物,包括分子胶和异双功能降解物 (如上述的PROTACs),为蛋白质的药物干预提供了新模式。分子胶降解物是诱导E3泛素连接酶或其他蛋白降解复合物与蛋白靶相互作用的小分子,触发蛋白体或自噬降解。针对IMIDs的蛋白质组学研究鉴定到大脑中许多新底物的降解。PROTACs由两个连接的配体组成,一个参与靶标,另一个招募E3泛素连接酶,触发泛素化并随后对目标蛋白进行蛋白酶体降解。在最近的两项突破性研究中,蛋白组学揭示了在使用BET溴化域与邻苯二胺融合的竞争性拮抗剂治疗后,转录共激活因子 (包括BRD4) 的选择性蛋白降解。
7展望
蛋白质组学越来越被认为是一种强大且通用的工具,它提供了与疾病和药物作用的机制直接相关的独特信息,可用于阐明疾病失调的机制并监测药物作用。越来越多的成功案例证明了蛋白质组学方法用于识别疾病和药物机制,提供脱靶效应的证据,甚至提出药物再利用的机会。
文章中,作者也对未来的蛋白质组学应用进行了展望:
高灵敏度蛋白质组学技术的发展,将能够针对少数或单个细胞,对与细胞异质性、药物作用相关的亚细胞空间机制和分子疾病表型进行研究。
具有时空分辨率的深度蛋白质组分析,通过促进靶点验证和模型表征来支持早期药物发现。
空间蛋白质组学在药物治疗前后进行,可以在空间环境中直接可视化肿瘤适应和逃逸。
 //往期推荐\\\\
//往期推荐\\\\STTT | 中国医学科学院王辰院士团队发表尘肺蛋白基因组学重磅成果,揭示新的治疗策略

Cell Reports|蛋白质组学揭示HDAC抑制剂的全局性调控机制

机制“挖掘机” | 中南大学陈利玉团队蛋白组两篇文章,深入揭示纳米银抗菌机制

药物研究新思路,Nat Comm:磷酸化组揭秘骨髓瘤治疗新策略


参考文献Felix Meissner, et al., 2022, The emerging role of mass spectrometry-based proteomics in drug discovery. Nature Reviews Drug Discovery.
本文由景杰学术团队报道,欢迎转发到朋友圈。如有转载、投稿等其他合作需求,请文章下方留言,或添加微信ptm-market咨询。