说出您的故事 | 解锁细胞热位移CETSA实验--北京大学

卞薇洁
博士研究生
北京大学
来鲁华课题组

细胞热位移实验(CETSA)作为一种检测药物靶向性的手段,其主要缺陷是灵敏度仍然还不够高,传统的Western blot通常需要较高浓度的药物靶蛋白的热稳定性才会发生比较明显的变化。并且传统Western blot操作过程中受到跑胶,转膜,抗体孵育,显影等人工操作的影响,重复性会相对较差。且实验过程较为繁琐,费时费力,无法实现高通量的药物筛选。
而全自动毛细管Digital Western作为一种创新的技术,可以直接定量检测蛋白质的含量变化;其重复性好,消除了传统Western blot方法不可避免的差异;灵敏度高,可检测pg级别的蛋白质,因此蛋白含量的变化也比较容易被检测到;高通量,其可以全自动方式3小时内提供24个样本的数据,将有助于化合物的高通量筛选。
昼夜节律即生物钟对于维持我们的生理和代谢功能尤为重要,最近的研究发现昼夜节律的破坏与一些慢性疾病比如情绪障碍和代谢性疾病以及癌症有关,因此靶向生物钟网络的小分子调节剂成为疾病治疗的新策略。CRY1蛋白作为生物钟网络最主要的抑制子发挥作用,由于其晶体结构已知也被用于药物设计中,我们通过CAVITY程序对口袋分析发现一别构口袋可药性良好,但至今没有靶向该口袋的小分子调节剂被发现。因此我们通过理性药物设计的方法,以期望更高效的获得新型的生物钟小分子调节剂。
前期结果中通过计算机辅助的药物设计,我们发现了一个潜在活性化合物X,并且通过SPR、MST等实验验证了化合物X与CRY1的体外靶向性。因为CRY1作为转录抑制子位于细胞内,因此我们需要检测药物在细胞中与靶蛋白的相互作用。细胞热位移实验(CETSA)是2013年以Pär Nordlund为首的瑞典Karolinska研究所团队研发的实验技术,用于检测药物在细胞中的靶向性。该实验原理是即随温度提高,蛋白会解折叠在细胞中迅速沉淀,通过监测加热后可溶性蛋白含量分析其熔解曲线可表征其热稳定性,而药物分子与靶蛋白的结合会改变其热稳定性。因此我们使用全自动毛细管Digital Western(即Simple Western)定量蛋白质表达分析系统进行细胞热转移实验分析。
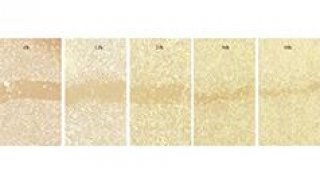
我们选用293T细胞系,外源转染CRY1-Flag,12h后加入DMSO / 化合物X孵育3小时,裂解细胞,使用Wes(全自动毛细管Digital Western型号之一)定量分析靶蛋白在加药处理后随温度的变化情况。可以看到化合物处理后相比于Control组,热稳定性得到了明显的提升(图1),说明化合物X在细胞内确实可以靶向CRY1蛋白。
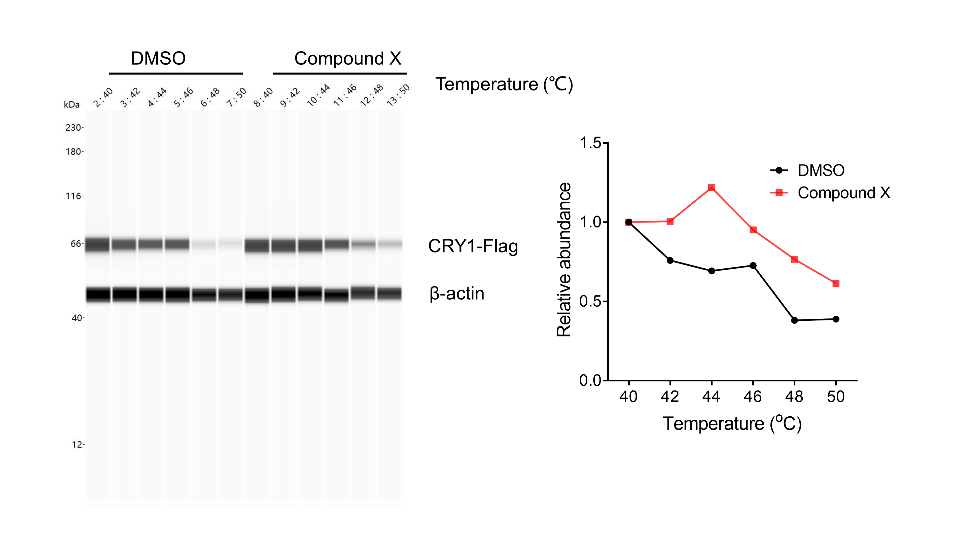
图1. 化合物X可以增强CRY1热稳定性。全自动毛细管Digital Western检测化合物X对CRY1热变性温度的影响(左)CETSA 熔解曲线(右)。
CETSA作为一种检测药物靶向性的手段,其主要缺陷是灵敏度仍然还不够高,传统的Western blot通常需要较高浓度的药物靶蛋白的热稳定性才会发生比较明显的变化。并且传统Western blot操作过程中受到跑胶,转膜,抗体孵育,显影等人工操作的影响,重复性会相对较差。且实验过程较为繁琐,费时费力,无法实现高通量的药物筛选。而全自动毛细管Digital Western作为一种创新的技术,可以直接定量检测蛋白质的含量变化;其重复性好,消除了传统Western blot方法不可避免的差异;灵敏度高,可检测pg级别的蛋白质,因此蛋白含量的变化也比较容易被检测到;高通量,其可以全自动方式3小时内提供 24个样本的数据,将有助于化合物的高通量筛选。
在该部分研究中,我们成功发现了一个新型的CRY1调节剂,可以增强生物钟网络的振荡,并且我们通过各种分子生物学手段验证了其靶向性。而靶向生物钟网络由于化合物毒副作用低、多效性等特点具有很大优势,可以用于到一些生物钟破坏相关疾病的治疗中。比如近些年研究发现生物钟破坏与癌症有十分密切的关系,因此生物钟的小分子调节剂或许可以改善药物治疗效果并提高患者的生存率,生物钟小分子调节剂的开发具有很大的应用前景。

扫码解锁更多全自动Digital Western资料

参考文献:
1. Rasmussen, E. S., Takahashi, J. S. & Green, C. B. Time to target the circadian clock for drug discovery. Trends Biochem Sci, doi:10.1016/j.tibs.2022.04.009 (2022).
2. Molina, D. M. et al. Monitoring Drug Target Engagement in Cells and Tissues Using the Cellular Thermal Shift Assay. Science 341, 84-87, doi:10.1126/science.1233606 (2013).
3. Kinouchi, K. & Sassone-Corsi, P. Metabolic rivalry: circadian homeostasis and tumorigenesis. Nat Rev Cancer 20, 645-661, doi:10.1038/s41568-020-0291-9 (2020)