IF 12.822 | J ADV RES:复旦大学徐建青和张晓燕团队开发出快速评价CAR-T疗法安全性的动物模型

近年来,CAR-T疗法在血液肿瘤治疗上成效显著,虽有多款CAR-T疗法相继获批,然而在实体瘤的治疗上仍然面临着众多挑战,特别是肿瘤特异性抗原(TSA)缺乏产生的肿瘤非靶向毒性(On-target off-tumor toxicity)而引发的安全性担忧。目前的临床前研究多采用免疫缺陷小鼠评估CAR-T疗法的抗肿瘤作用,而鲜少评估CAR-T疗法的毒副作用,尤其是攻击正常组织的潜在毒性。究其原因,主要是由于人源CAR-T不能交叉识别鼠源靶点,且目前尚无合适可用的安全性评价动物模型。
2022年8月,复旦大学附属中山医院生物治疗中心、复旦大学生物医学研究院和上海市公共卫生临床中心的徐建青和张晓燕教授团队在权威期刊Journal of Advanced Research(2021IF/JCR分区:12.822/Q1)以长篇“Article”形式发表了题为“Rapid generation of a mouse model for evaluating on-target normal tissue toxicity of human CAR-T cells using replication-defective recombinant adenovirus”的原创性研究,首次报道了利用复制缺陷型重组腺病毒递送人源靶抗原快速构建人源化小鼠模型以合理评估CAR-T疗法安全性,为CAR-T疗法的临床前安全性评价提供了一种备选动物模型。


研究方法与结果

1.重组腺病毒递送人源靶抗原至小鼠肝脏
通过体外HEK293T细胞感染模型,研究人员首先验证了复制缺陷型重组腺病毒Ad5-HER2(图1A)【吉凯基因产品】可以表达高水平的HER2抗原和共表达的萤火虫荧光素酶(图1B)。其次,通过腹腔注射0、2.5E+8、5E+8、1E+9 PFU 四个不同剂量的Ad5-HER2,一周后采用小动物活体成像仪检测荧光素酶活性以间接反映HER2抗原表达和分布,以及处死小鼠取肝脏组织进行免疫组化分析。研究结果显示,重组腺病毒主要感染小鼠肝脏,且小鼠肝脏人源HER2抗原表达水平与病毒感染剂量呈正相关(图1C-E),提示控制病毒感染剂量可以模拟肿瘤相关抗原表达谱。
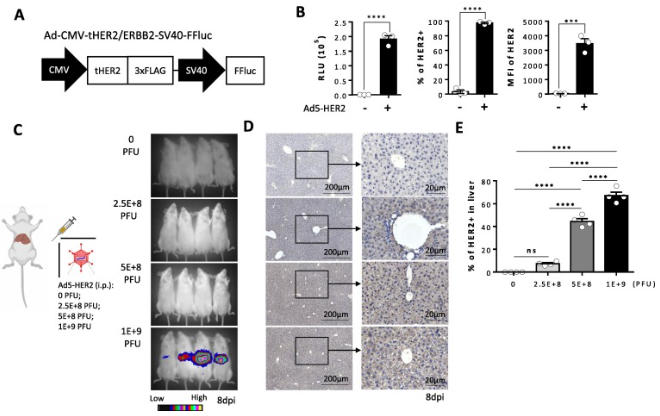
图1.重组腺病毒递送人源靶抗原至小鼠肝脏
2.人源抗原阳性小鼠肝脏细胞激活和富集CAR-T细胞
通过腹腔注射0、2.5E+8、5E+8、1E+9 PFU 四个不同剂量的Ad5-HER2以构建肝脏人源化小鼠模型,静脉回输HER2 CAR-T细胞,5天后检测小鼠血清T细胞活化相关细胞因子IFN-γ和TNF-α含量。研究结果显示,T细胞活化相关细胞因子IFN-γ和TNF-α含量随病毒感染剂量升高而升高,表明肝脏细胞表达的人源HER2抗原激活HER2 CAR-T细胞分泌活化相关细胞因子(图2A)。取小鼠肝脏组织制备单细胞悬液后进行流式细胞术检测。研究数据显示,高抗原表达的小鼠肝脏富集大量的CAR-T细胞(图2B)。
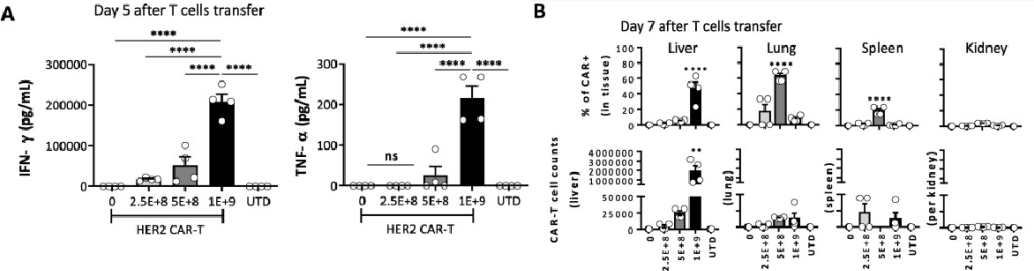
图2.人源抗原阳性小鼠肝脏细胞激活和富集CAR-T细胞
3.传统CAR-T细胞引起肝脏人源化小鼠的急性肝毒性
通过腹腔注射0、2.5E+8、5E+8、1E+9 PFU 四个不同剂量的Ad5-HER2以构建肝脏人源化。
小鼠模型,静脉回输HER2 CAR-T细胞,监测回输后小鼠体重变化、生存情况以及血清谷丙转氨酶(ALT)和谷草转氨酶(AST)含量变化。研究结果显示,输注传统的HER2 CAR-T细胞后导致小鼠体重急剧下降(图3B),存活时间不超过一周(图3C),且血清肝损伤相关ALT和AST急剧升高(图3D),提示致死性的急性肝毒性。
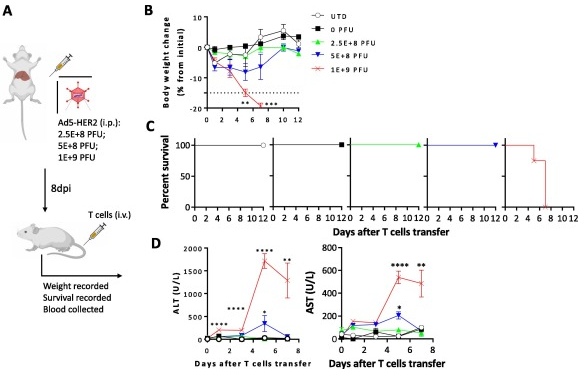
图3.传统CAR-T细胞引起肝脏人源化小鼠的急性肝毒性
4.缺氧微环境调控CAR-T细胞豁免肿瘤相关抗原阳性的正常组织
研究人员进一步利用该动物模型评估了肿瘤微环境激活杀伤的新型CAR-T技术,研究数据证实缺氧微环境调控的CAR-T疗法具有极高的安全性和耐受性,相对于传统CAR-T细胞,实验组小鼠体重无显著变化,生存不受影响,且无急性肝损伤指征(图4)。

图4.缺氧微环境调控CAR-T细胞安全性佳
综上所述,研究人员利用复制缺陷型重组腺病毒递送人源靶抗原至正常组织模拟肿瘤相关抗原(TAA)的表达,通过腹腔注射重组腺病毒1周左右即可获得表达人源靶抗原的正常肝脏组织,随后静脉回输CAR-T细胞,定期监测1周内小鼠体重变化、生存时间、肝损伤相关指标和炎症浸润,实现2周内快速评估CAR-T疗法安全性(图6)。
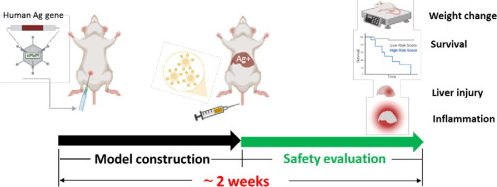
图5.图文摘要
本研究获得了“十三五”重大专项、国家科技部重点研发计划和上海市申康-促进市级医院临床技能与临床创新三年行动计划等课题资助。

吉凯助力

本研究用于构建肝脏人源化小鼠模型所使用的复制缺陷型重组腺病毒Ad5-HER2产品均由吉凯基因提供,助力高水平的科学研究。
作者简介
深圳市第三人民医院生物治疗中心的廖启彬(博士)、复旦大学生物医学研究院2017级博士研究生刘卓群、上海市公共卫生临床中心朱翠松和上海市公共卫生临床中心何欢(博士)为并列第一作者。复旦大学附属中山医院生物治疗中心、复旦大学生物医学研究院和上海市公共卫生临床中心的徐建青(研究员)、张晓燕(研究员)和复旦大学附属金山医院的孙荣勋(主任)为本文的共同通讯作者。



1.实验技术干货
2.蛋白质组学研究
3.腺病毒简介及应用
6.单细胞测序
8.悬浮细胞专用病毒
10.测序技术研究与应用
12.腺相关病毒选择/应用
13.表观遗传研究
14.文章解析
15.国自然课题设计思路解析
16.生物信息分析及工具
17.外泌体研究
18.肿瘤免疫研究
19.高分文章
20.吉凯病毒神经方向应用案例

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章











