饶子和、刘志杰小组最新《自然》子刊解析蛋白机构
来自中国科学院生物物理研究院国家生物大分子国家重点实验室(National Laboratory of Biomacromolecules),天津医科大学免疫学系,清华大学生命科学实验楼,美国乔治亚州大学,芬兰坦佩雷大学的研究人员对p100蛋白这种多功能转录共激活因子的结晶结晶进行了进一步的分析,部分解释了p100在转录和剪接中的不同作用,有利于进一步了解p100蛋白的功能和作用机制。这一研究成果公布在《Nature-Structural Molecular biology》杂志上。
文章的通讯作者为生物物理研究所的刘志杰研究员,以及天津医科大学的杨洁教授,同时参予研究的还有清华大学饶子和院士,以及赵敏(Min Zhao,音译,第一作者),Neil Shaw(第一作者)。
原文检索:
Published online: 15 July 2007; | doi:10.1038/nsmb1269
The multifunctional human p100 protein 'hooks' methylated ligands
[Abstract]
IL-4 信号传导通道是人体免疫反应的重要通道之一,它们通过IL-4受体调控细胞周期而诱导了T细胞的增殖分化,在如过敏,哮喘,癌症等许多疾病中有极为重要的作用.。
多功能转录共激活因子p100蛋白是此通道中的一个非常重要多种功能蛋白。p100蛋白发现至今已有近十年历史,到目前为止,发现的p100蛋白涵盖的功能有:p100蛋白是EBNA2的转录调控激活因子;p100蛋白与转录因子cMyb和丝氨酸/苏氨酸激酶pim1 结合并增强活性;p100蛋白与病毒mRNA合成密切相关的nsp1特异性结合;p100蛋白是RNA介导的沉默复合物(RISC)的重要亚基之一,并能够与富含U·I和I·Upair的dsRNA相互作用;p100蛋白作为共激活因子促进STAT5和STAT6介导的转录活性调控,并形成多种蛋白质复合物,包括RNApolII-p100-STAT6;p100-STAT5;STAT6-p100-RHA等。
然而到目前为止还没有有关p100的全面的结构和功能研究的报道,生物物理研究所生物大分子国家重点实验室人源多功能转录共激活因子p100结构与功能研究(刘志杰组)的研究人员表达和纯化了人源p100蛋白Tudor结构域,并获得了晶体,解析了其精细三维结构,为进一步研究p100和蛋白质复合物的结构和功能提供了有利证据。
在这篇文章中,重点实验室的研究人员与天津医科大学杨洁研究小组的成员合作进一步对p100蛋白的结构和功能分析进行分析——杨洁研究小组主要从事转录激活因子-人类p100蛋白参与pre-mRNA剪接加工分子机制方面的研究,他们发现人类p100蛋白是一个关键的转录调控子,能通过在启动子特异性激活因子和基本转录机器之间形成连接从而促进基因转录。
文章新发现:
证明p100蛋白的tudor和SN(TSN)位点能于U核内小核糖核蛋白/核小核糖核蛋白( small nuclear ribonucleoprotein,snRNP )复合物——由小分子核内RNA和蛋白构成的复合体,前体mRNA在
上面进行加工,相互作用,这说明p100在前体mRNA加工工程中的作用。
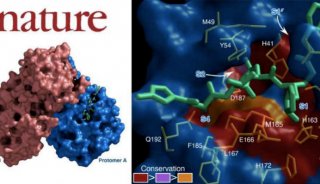
确定了p100 TSN位点的结晶结构,描绘了p100可能具有功能的分子基础。
这种结构类似于hook,钩状,一条铰链状结构控制着hook的移动和方向。
这些发现告诉我们一种保守的芳香族cage钩住了snRNPs的甲基化基团,将p100锚定在剪接体(spliceosome)上,这种结构部分解释了p100在转录和剪接中的不同作用。
剪接体(spliceosome)
在剪接过程中形成的剪接复合物称为剪接体,剪接体的主要组成是蛋白质和小分子的核RNA(snRNA)。复合物的沉降系数约为50~60S,它是在剪接过程的各个阶段随着snRNA的加入而形成的。也就是说在完整的pre-mRNA 上形成的一个剪接中间体。
剪接体的装配同核糖体的装配相似。依靠RNA-RNA、RNA-蛋白质、蛋白质-蛋白质等三方面的相互作用。可能比核糖体更复杂,要涉及snRNA的碱基配对, 相互识别等。