教你一分钟搞定常见元素分析方法
氯离子测定
银量法:
• 在近中性的氯化物溶液中,用硝酸银标准溶液滴定,铬酸钾为指示剂;
• 由于铬酸跟与银离子反应,生成铬酸银的溶解度略大于氯化银;
•
因此,当溶液中氯离子反应完全后,过量的硝酸银立即与铬酸根形成稳定的桔红色铬酸银沉淀,从而判断终点。
Ag+ + Cl- = AgCl
Ag+ + CrO42- = Ag2CrO4
汞量法:
原理:微酸溶液中,氯离子与汞离子能生成难离解的二氯化汞,滴到终点时汞离子可与指示剂二苯卡巴腙反应生成淡紫色络合物。
测试方法:待测液中加溴酚蓝,用0.1mol/L硝酸调至黄色,再用硝酸汞标准溶液滴至淡紫色。
2.硫酸根离子测定
硫酸钡重量法:
将盐样溶液调至弱酸性(甲基红指示剂,用盐酸调至红色),加入适当过量的氯化钡溶液,定量地沉淀溶液中的硫酸根,生成硫酸钡白色沉淀,沉淀经过滤、洗涤、灼烧(或烘干),然后称重,计算硫酸根的含量。
Ba2++SO42-=BaSO4
3.磷酸盐测定
磷酸盐的测定方法主要有磷钼蓝分光光度法和磷钒钼黄分光光度法。磷钼蓝分光光度法可测定3mg/L以下的,而磷钒钼黄分光光度法适应于测定5mg/L以上的。
磷钼蓝分光光度法(3mg/L以下):
水样中的正磷酸盐,与钼酸铵试剂在强酸溶液中作用,生成磷钼酸铵:
PO43-+3NH4++12MoO42-+24H+ = (NH4)3PO4·12MoO3 +12H2O
磷钼酸铵在一定酸度下,可被还原剂(如氯化亚锡、抗坏血酸或称维生素C、亚硫酸钠等)还原成蓝色化合物,叫“钼蓝”:
(NH4)3PO4· 12MoO3+SnCL2+H+(MoO2 ·4MoO3)2 ·H3PO4(钼蓝大致成分)
测量波长为660钠米
氯化亚锡不能用量过多,否则“钼蓝”会进一步还原,使溶液呈浅绿色,妨碍测定。显色速度和颜色强度与溶液的温度有关,温度每升高1℃颜色强度大约增加1%,故比色溶液间的温差不能超过2℃。
磷钼黄分光光度法(5mg/L以上):
• 在[H2SO4]=0.6mol/L的酸度下,磷酸盐与钼酸盐和偏钒酸盐形成黄色的磷钒钼酸。
•2H3PO4+22(NH4)2MoO4+2NH4VO3+23H2SO4 → P2O5·V2O5·22MoO3·n H2O+23(NH4)2SO4+(26-n) H2O
• 磷钒钼酸可在420nm的波长下测定。
4.溴单质测定
工业溴中所含游离溴和氯,用过量的碘化钾与之反应,释出的碘用硫代硫酸钠标准溶液滴定,测得溴氯总量,由总量中扣除氯量,即得溴含量。反应式如下:
• Br2+2KI=2KBr+I2
• 2Na2S2O3+I2=2NaI+Na2S4O6
5.溴离子测定
分光光度计法:
酸性介质中,氯胺T将溴化物氧化为单质溴,溴与酚红反应生成四溴分红。
试剂溶于乙酸-乙酸钠溶液,加3滴酚红,0.4L氯胺T,一分钟后加硫代硫酸钠脱氯,定溶,然后用590nm测波长。
6.钙离子测定
EDTA滴定法:
在pH≥12的溶液中,EDTA与钙离子生成稳定的可溶性络合物。钙指示剂【2-羟基-1-(2-羟基-4-磺酸基-1-萘基偶氮)-3-萘甲酸】,与钙离子生成稳定性较弱的可溶性酒石红色络合物,与镁无此反应。当用EDTA滴定时,溶液中的Ca2+逐步被EDTA阴离子(H2Y2-)络合,并且钙与钙指示剂络合物(CaIn+)中的钙也被EDTA夺出,结合成无色的络合物,等终点时,溶液呈现游离出的钙指示剂阴离子(In-)的纯蓝色。
• Ca2+ + H2Y2-=CaY2- + 2H+
• Ca2+ + In-=CaIn+(酒石红色)
• CaIn+ + H2Y2- + 2OH-=CaY2- + In-(纯蓝色+2H2O)
7.镁离子测定
EDTA滴定法:
在pH≈10的样品溶液中,EDTA与镁离子生成稳定的络合物。铬黑T指示剂与镁离子生成稳定性较弱的酒石红色络合物。当用EDTA标准溶液滴定时,EDTA逐步络合溶液中钙、镁离子,并夺取指示剂络合物的钙、镁离子,终点时,溶液呈现铬黑T阴离子(HIn2-)的蓝色。
• Ca2+(Mg2+)+ H2Y2- = Ca(Mg)Y2-+ 2H+
• Mg2+ + HIn2- = MgIn- + H+
• MgIn-(酒石红色)+ H2Y2- = MgY2- + HIn2-(蓝色)
8.钾离子测定
四苯硼酸纳重量法:
四苯硼酸钠溶液加至微酸法样品溶液中,生成稳定的四苯硼酸钾沉淀,经过滤、干燥、称重测得钾离子量,计算出样品中的含量。反应式如下:
(C6H6)4B- + K+ = K(C6H5)B
9.铁离子测定
邻菲罗啉法:
在pH=2-9的溶液中,Fe2+与邻二氮杂菲(邻菲啰啉)生成稳定的橙红色配合物。该法可用于试样中微量Fe2+的测定,如果铁以Fe3+的形式存在,由于Fe3+能与邻二氮杂菲生成淡蓝色的配合物,所以应预先加入盐酸羟胺(或抗坏血酸等)将Fe3+还原为Fe2+。
• 该法的灵敏度、稳定性、选择性均较好。
• 但Bi3+、Cd2+、Hg2+、Zn2+、Ag+等离子与邻二氮菲生成沉淀;
• Cu2+、Co2+、Ni2+等离子则形成有色配合物,因此,当这些离子共存时,应注意它们的干扰作用。
• 铝和磷酸盐令量大时,使反应速度慢;CN-存在将与Fe2+生成配合物,严重干扰测定,需预先除去。
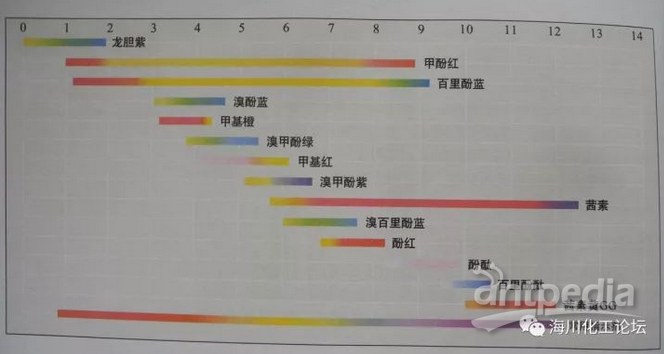
最后附上各类指示剂的显色范围: