清华大学教授连发Cell,Nature文章:首发性结构生物学成果
生物通报道:呼吸作用是生物体最基础的生命活动之一,线粒体呼吸链复合物在其中扮演了重要的角色,这一复合物出现缺陷会导致多种疾病。2012年清华大学的杨茂君教授曾在Nature杂志上报道了II-型线粒体呼吸链复合物I的重要成果,这是当时世界上所解析的最大、也是最复杂的膜蛋白超级复合物结构。在此基础上,今年下半年,杨茂君教授研究组又接连在Cell,Nature上发表重要成果,首次报道了线粒体呼吸链超级复合物:I1III2IV1的冷冻电镜三维结构。
最新研究成果公布在12月1日的Cell杂志上,文章的通讯作者是杨茂君教授,他早年毕业于吉林大学,致力于与传染病、癌症等人类重大疾病息息相关的可溶性蛋白及膜蛋白结构与功能的研究,并针对这些蛋白质的高分辨晶体结构为基础的小分子化合物筛选及设计。
上个世纪70年代,美国科学家Hackenbrock CR提出细胞呼吸是由线粒体内膜上的四个呼吸链蛋白复合物分步完成的,这四种蛋白复合物分别为复合物I(CI,NADH脱氢酶)、复合物II(CII,琥珀酸脱氢酶)、复合物III(CIII,细胞色素c还原酶)和复合物IV(CIV,细胞色素c氧化酶)。所有这些复合物都是由众多蛋白亚基和多个电子传递辅基组成的,并且在结构和功能上都是独立的。
2000年,科学家们发现这些复合物并不是完全独立存在的,而是相互结合形成更高级的组织形式——呼吸链超级复合物。后续研究发现,单独的呼吸链复合物之间通过不同的组合方式相互结合,可以形成多种类型的超级复合物,其中具有完整呼吸活性的超级复合物又被称作呼吸体。哺乳动物中丰度最高、最为重要的呼吸体是由1个CI,1个CIII的二聚体和1个CIV组成的,即I1III2IV1。
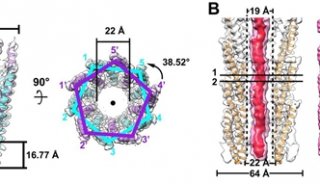
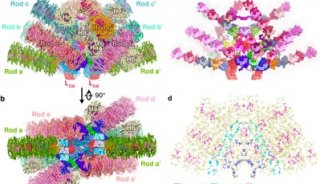
据报道,哺乳动物呼吸体I1III2IV1是由81个蛋白亚基(70种不同蛋白分子)所构成的分子量高达1.7兆道尔顿的膜蛋白超级复合物。各复合物之间的结合相对比较松散,所以呼吸体并不适合利用晶体学的手段进行研究,却非常适于应用冷冻电镜进行结构解析。
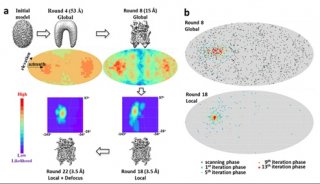
今年9月,杨茂君教授研究组获得了高质量的冷冻电镜数据,并利用单颗粒三维重构的方法最终获得了整体5.4Å的近原子分辨率结构,其中复合物I和复合物III的分辨率达到3.97Å。
并且这一研究也解析了各呼吸链复合物之间电子的传递过程,在此基础上,研究组更进了一步,细致分析了复合物的精确组织,他们报道了分辨率为4.0Å的猪呼吸链超级复合物主要结构——大小为1.7 MDa的I1III2IV1。
从这一结构中,研究人员发现复合物III的二聚体III(CIII)和复合物IV(CIV)都结合在L形复合物I(CI)的同一侧。一些CI附属结构亚基,比如NDUFA11、NDUFB4、NDUFB8 和 NDUFB9直接能作用于CI,CIII和CIV的组织。
这些结构发现指出了电子从NADH转移到细胞色素c上一种可能机制,这也为未来解析呼吸的具体过程提供了新的平台。
(生物通:万纹)
作者简介:
杨茂君 博士
教授、博导
1995-1999 吉林大学,学士
1999-2003 中国协和医科大学,博士
2003-2004 德国吕贝克大学,高级访问学者
2004-2008 美国西南医学中心,博士后
2008-至今 清华大学生命科学学院,教授、博导
主要科研领域与方向
本实验室主要围绕与传染病、癌症等人类重大疾病发生息息相关的可溶性蛋白及膜蛋白进行结构与功能研究,以及针对这些蛋白质的高分辨晶体结构为基础的小分子化合物筛选及设计。近年来主要在细胞感应外界信号以及物质跨膜转运,蛋白质泛素化调控两个方面得到了部分研究成果。