生物物理所完成细菌淀粉样纤维分泌通道的结构解析
12月1日,PNAS 杂志在线发表了中国科学院生物物理研究所黄亿华研究组对负责细菌表面淀粉样纤维(β-amyloids)分泌通道的结构解析成果。
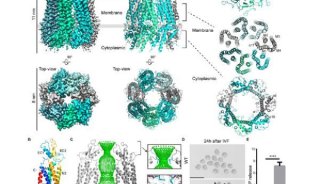
淀粉样纤维与许多神经退行性疾病的发生密切有关,如阿兹海默症、亨廷顿症和帕金森症等。然而,在细菌表面,存在一类功能性的淀粉样纤维(Curli),为细菌形成菌膜(biofilm)所必需。黄亿华研究组成功解析了负责curli分泌的通道蛋白CsgG九聚体2.9埃的晶体结构。研究显示,CsgG通过9聚化,由每个单体贡献4条跨膜β链,形成了一个跨越细菌外膜由36条β链所组成的分泌通道。这是目前已知的在细菌外膜上最大的、由最多β链所围成的β桶状整合膜蛋白。该通道的选择性由向内突出的氨基酸形成的垛叠环限制,大小只有12 Å,表明组成curli的亚基是以一种未折叠的方式穿过CsgG通道。在结构的基础上,通过细菌遗传学实验和生物化学分析,阐释了功能性淀粉样纤维生物生成的机理,并可为设计抑制菌膜形成的新型抗生素提供重要信息。Nature杂志近期也在线报道了由荷兰,法国,英国和美国科学家所组成的研究团队对CsgG结构的解析。
该研究工作得到了生物物理所“膜蛋白团队”各成员组,特别是张凯研究员的大力协助。黄亿华研究员为本论文的通讯作者,黄亿华研究组助理研究员曹保华博士和张凯研究组的博士生赵岩为论文的共同第一作者,黄亿华研究组的硕士生寇永君和倪冬春参与了部分工作。该研究工作得到了科技部“973”计划、中国科学院战略性先导科技专项(B类)以及国家自然科学基金的资助。
CsgG形成的跨膜九聚体通道结构
-
焦点事件
-
项目成果
-
项目成果

-
项目成果