Nature子刊:微管解聚型驱动蛋白的结构机制
来自同济大学生命科学与技术学院,法国国家科研中心I2BC研究所的研究人员发表了题为“Insight into microtubule disassembly by kinesin-13s from the structure of Kif2C bound to tubulin”的文章,阐明了中间型驱动蛋白解聚微管的结构机制。
这一研究成果公布在Nature Communications杂志上,文章的通讯作者分别是同济大学王春光研究员,以及法国国家科研中心I2BC研究所Benoît Gigant。第一作者为博士生王伟毅。
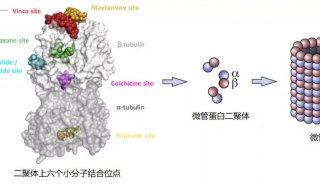
中间型驱动蛋白(internal kinesins or kinesin-13s)是驱动蛋白家族中一个特殊的亚家族,其马达结构域与其他运输型驱动蛋白的马达结构域高度同源,但其生物活性却是从微管末端来解聚微管,从而在胞内微管动态调控和有丝分裂过程中发挥重要的生物学功能。
为了阐明这类驱动蛋白解聚微管的结构机制,研究人员通过解析中间型驱动蛋白Kif2C与微管蛋白tubulin的复合物晶体结构,发现Kif2C结合到tubulin分子表面时发生了大幅度构象变化,形成了分子间的多位点结合,从而稳定了tubulin分子的弯曲构象,这可能是Kif2C能把最末端的tubulin分子从微管上解离下来的主要原因。
这一研究结果不仅促进了对Kif2C微管解聚机制的认识,还对理解不同驱动蛋白成员之间生物活性和工作机制的差异具有重要价值。
-
会议会展