Nature解析多功能的无序蛋白
精密折叠的结构,给蛋白赋予了多重功能。不过,细胞中也存在不少未折叠的松散蛋白,这些无序蛋白IDP(intrinsically disordered protein)也能执行多种功能。本周的Nature杂志上,Scripps研究所(TSRI)的科学家们,阐述了一个重要IDP实现多重功能的策略,揭示了这类蛋白的调节机制。
“我们发现的机制,很可能是IDP调节活性的通用机制,” TSRI的Peter E. Wright教授说。研究人员针对腺病毒的E1A蛋白进行了研究,该蛋白是研究IDP的理想模型。腺病毒在感染细胞后,会很快开始生产E1A蛋白。E1A能够与宿主的多种关键分子相互作用,使病毒能够快速征用细胞的复制机制。
IDP往往在细胞中扮演着重要角色,例如充当大型蛋白互作网络中的重要分子枢纽。许多IDP蛋白都涉及重要的疾病,包括肿瘤抑制蛋白p53,帕金森症中的α-突触核蛋白,以及阿尔茨海默症中的β-淀粉样蛋白和tau蛋白。
IDP的柔性结构很“粘”,可以与多个分子发生相互作用,而研究人员希望了解这种互作的调控机制。此前,人们一直通过核磁共振来研究蛋白的相互作用,但对于E1A这样的粘性蛋白来说,核磁共振的效果并不理想。
在这项研究中,科学家们采用量子光学技术——单分子FRET,成功解析了无序蛋白与其他生物分子的动态互作。单分子FRET通过荧光信标系统,解析蛋白各部分之间的距离。这一技术使研究人员得以实时监测E1A的形态改变,体现E1A与其他蛋白的偶联和解偶联。这一技术非常灵敏,可以在极低的蛋白浓度下使用,甚至可以集中分析单个E1A蛋白。
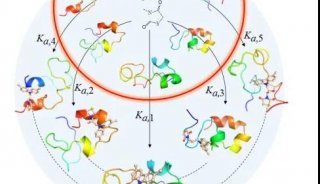
在单分子FRET技术的帮助下,研究人员详细分析了E1A与两个重要蛋白结合时的亲和力。他们监测了这种亲和力在不同条件下的改变,并由此阐明了E1A多重功能背后的调节机制。
研究显示,E1A与许多折叠蛋白一样,采用被称为变构的基础调节机制。当一个分子结合到E1A上时,会改变E1A其他区域的结合能力。对于绝大多数使用变构机制的蛋白来说,一个分子的结合会促进其他位点的结合,即产生正协同效应,只有少数蛋白属于负协同效应。但E1A的两个主要结合区域之间,既可以产生正协同效应,也可以产生负协同效应,这取决于E1A的另一个区域是否已被占据。
这项研究可以帮助人们理解,E1A这种无序蛋白如何实现其功能复杂性,同时也揭示了这类蛋白调控自身活性的机制。与宿主相比,病毒的基因组非常小,其蛋白的多重功能就显得尤为重要。研究还显示,一些与E1A结合的关键宿主蛋白,本身也是枢纽型的IDP,这就进一步拓展了E1A的功能复杂性。