中科院Cell发现重要离子通道
来自中科院、克利夫兰州立大学、清华大学的研究人员证实,TMCO1是一个内质网Ca2+过载激活的Ca2+通道。这一重要的研究发现发布在5月19日的《细胞》(Cell)杂志上。
中科院动物研究所的唐铁山(Tie-Shan Tang)研究员及克利夫兰州立大学周爱民(Aimin Zhou)教授是这篇论文的共同通讯作者。
钙离子(Ca2+)是一种多用途的细胞内信号,控制了许多不同的细胞功能,例如收缩、分泌、记忆形成、基因转录、细胞生长和细胞死亡等。内质网(ER)是细胞内主要的Ca2+库。要实现正常的Ca2+信号,ER中的Ca2+浓度([Ca2+]ER)必须维持在稳定状态,ER Ca2+稳态混乱与许多严重疾病有关。各种生理刺激物刺激细胞可导致IP3介导Ca2+从ER释放及耗尽Ca2+库。细胞进化出了一种叫做钙池操纵的钙进入(store-operated Ca2+ entry, SOCE)或容量性Ca2+内流(capacitative Ca2+ entry,CCE)的机制来再填充细胞及ER Ca2+库。研究已证实CRAC通道负责SOCE活性和储存耗竭后Ca2+库再填充。但目前尚不清楚是否还存在一种机制在Ca2+库超载时让ER排出过量的Ca2+。
TMCO1缺陷综合征是以独特的颅面畸形、骨骼异常、精神发育迟缓、共济失调和许多其他的临床症状为特征。TMCO1基因中的一个移码突变被确定为是俄亥俄东北部阿米什人中这一常染色体隐性遗传综合征的致病原因。TMCO1基因编码了一个预计包含188个氨基酸的蛋白,它的c.139_140delAG造成严重的蛋白质截断(p.Ser47X)导致了蛋白质功能丧失。近期有研究报道了一些TMCO1基因无义突变的非阿米什人病例。最初被认为代表一种独特疾病的TMCO1缺陷综合征,属于具有遗传异质性的CFT dysplasia spectrum。
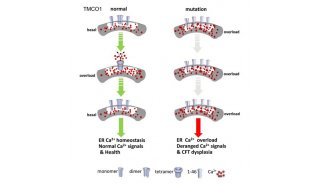
在这篇Cell文章中,研究人员证实TMCO1作为一种ER跨膜蛋白积极防止了过度填充Ca2+库,充当了“Ca2+过载激活的Ca2+通道”(CLAC通道)。TMCO1可响应ER Ca2+过载经历可逆的同源四聚化,在Ca2+耗尽的情况下分解,在巨大的脂质体上形成了一个Ca2+选择性离子通道。TMCO1基因敲除小鼠重现了人类CFCT dysplasia spectrum的主要临床特征,显示细胞中ER Ca2+严重的错误运作。
研究结果表明,TMCO1提供了一种保护机制防止ER Ca2+库过度填充Ca2+离子。
唐铁山研究员的主要研究方向为神经细胞在生理和病理状态下钙信号的功能调控。近年来所取得的研究成果发表在国际核心学术期刊,包括 Neuron、PNAS、J Neuroscience、 Development、J Biol Chem 等。迄今共发表SCI收录论文25余篇。
2003年,唐铁山博士曾作为第一作者在Neuron上发表文章,发现一个基因突变导致的异常高钙水平可能是引起亨廷顿氏症相关神经元死亡的原因。这为探索大脑叫做纹状体的结构的选择性神经元死亡的起因提供了新线索。
2012年,唐铁山领导中科院的研究人员揭示出了线粒体钙信号失调、氧化应激与亨廷顿氏舞蹈病(HD)基因组DNA损伤之间的因果关系,这一发现对于了解HD的发病及进程机制,以及开发出有效的治疗策略具有重要意义。相关研究发表在JBC上。
2013年,唐铁山研究员与中科院动物研究所的韩春生研究员及北京基因组研究所郭彩霞研究员合作,首次揭示了5hmC丢失可能是舞蹈病新的表观特征标记,同时也为该疾病的治疗开辟了一个新的方向。该成果在线发表于 Human Molecular Genetics杂志上。
-
焦点事件

-
精英视角

-
焦点事件

-
项目成果
-
项目成果
-
科技前沿
-
项目成果

-
项目成果