
诚信认证:
工商注册信息已核实! 扫一扫即可访问手机版展台
扫一扫即可访问手机版展台
自动生成和分析 Matrigel 中的 3D 细胞培养物
| 领域: | 细胞生物学 | ||
| 资料类型: | 其他资料 | ||
| 资料文件名 | 下载 |
|---|---|
自动生成和分析 Matrigel 中的 3D 细胞培养物 |
下载此篇资料 |
概要
P
l 在 Biomek FX 工作站上自动进行基质胶培养物的平板接种、药物治疗和染色
l 温度控制位置保持基质胶呈液体形式并诱导胶化
l 通过减少基质胶的使用,优化移液可节省成本
l 使用以下方法测定基质胶培养物中的细胞生长和凋亡诱导:
l 配备 SpectraMax MiniMax 300 成像细胞计数器的 SpectraMax i3X 多功能检测平台
l ageXpress Micro Confocal 共聚焦高内涵成像系统
简介
研究人员正在将三维 (3D) 细胞培养作为一种提高其疾病模型和药物研究预测价值的生物学相关性的方法。这些 3D 模型通常会提高细胞间相互作用的水平,并减少或消除了在标准单层培养物中观察到的明显的细胞-塑料介质间相互作用。有多种生成方法3D 细胞培养物,每种具有独特的优势和挑战,有些挑战可以通过自动化帮助克服。
在三维空间中培养细胞的一种常见方法是通过使用细胞外基质水凝胶如 Matrigel。Matrigel 和 2D 细胞培养物之间的差异可通过其不同的细胞形态很容易地看到(图 1),细胞极性和/或基因表达(Baker 和 Chen)。Matrigel 还可以研究细胞迁移和3D 结构形成,例如血管生成研究中的内皮细胞管形成
Matrigel 的独特特性之一是它仅在低温条件下是液态,在室温下或 37°C 下凝固成凝胶。 细胞通常生长在基质胶涂层上或包埋在较厚的基质凝胶层(图 1)中,补充介质通常添加到水凝胶层之上,随后凝固。在 Matrigel 中检测细胞生长也可能存在问题。检测方法包括使用读板机或成像设备
在细胞仍留在基质中或缓慢溶解基质胶的同时对其进行检测,以观察悬浮细胞或裂解物。所有这些步骤在手动执行时都面临重大挑战,我们将介绍我们如何利用自动化来进行平板接种、处理和制备 Matrigel 培养物进行分析。此外,自动化技术使用 384 孔板,可减少每个步骤中基质胶和其他昂贵试剂的使用量,从而节省大量成本。

图 1:在标准单层培养物 (A)、基质胶表面(B)或嵌入基质胶层中(C)的 HCT 116 细胞的图像。比例尺 = 500 微米。
自动化基质胶铺板和培养
Matrigel 工作流程在 Biomek FX 工作站(贝克曼库尔特公司)上自动进行,该工作站具有 96 通道头和 Span-8
移液器(图 2)。灵活的 Biomek 工作站配置了多个温度控制的 Peltier 位置以液体形式维持基质凝胶,并加热检测板以诱导凝胶聚合。96 通道头增强多通道选择性吸头移液 (EST),允许使用任何吸头模式。自动化细胞的无菌性操作通过使用无菌 Biomek 移液器吸头和 HEPA 过滤外壳进行保护,且无污染即使在细胞培养基中没有抗生素的情况下也能检测到无污染。
细胞铺板
用 FluoroBrite DMEM 培养基(Thermo Fisher科学)稀释冰上解冻的无酚红的基质胶(Corning)至6mg/ml,对于嵌入式培养,将 HCT 116 细胞加入至 100,000 个细胞/mL 的浓度。基质胶将(+/- 细胞)添加到深孔板的单柱中,该单柱在振荡的 Peltier 装置上用深孔适配器保持 4°C,。使用多通道 EST 功能以柱状方式向 384 孔黑壁透明底板 (Greiner) 的孔中加入 25 μL 。然后将该检测板在静态Peltier上加热至37°C,持续30分钟,以固化基质胶。然后将含有 10% FBS 的 75 μL FluoroBrite DMEM 培养基加入每个孔中。对于在基质胶表面的培养物生长,HCT 116 细胞添加到补充培养基中,而不是添加到基质胶中。最终细胞接种数量为2500 个细胞/孔用于嵌入式培养,8000 个细胞/孔用于表面培养。
如上所述,在接种基质胶培养时存在许多挑战。自动化能够始终如一地将移液枪头置于孔底上方 0.3 mm 处,使少量的基质胶将扩散到覆盖整个孔。需要手动移液会接触孔底(可能划伤和/或影响转移体积)或孔的侧面,导致基质凝胶液滴粘附在孔的侧面,且未能覆盖孔。通过手动转移可以实现稳定的孔覆盖唯一是将基质胶体积加倍至 50μL,导致实验成本翻倍。
自动化铺板的另一个优势是能够使用慢速抽吸、分配和混合速度以避免Matrigel 溶液中产生气泡。我们还向移液管吸头中额外抽吸少量基质胶,以避免分配至检测板时引入气泡。虽然它们是 Matrigel 培养物的常见抱怨,但
在自动平板接种后没有在培养物中发现气泡。培养物在处理和/或分析之前在 37°C 下在 5% CO2 培养箱中储存不同时间。
细胞生长检测
为测定基质胶表面培养物的初始细胞生长,在前三天的培养中,每天向孔中加入 100 μL XTT 试剂。使用 SpectraMax i3X 多功能检测平台在 475 nm 和 660 nm 处测量吸光度(“SpectraMax i3X 读板机”,Molecular Devices,图 2)。观察到线性生长速率 (R2 = 0.985),表明在该时间范围内生长 8000 个细胞(图 3A)。第 3 天吸光度的轻微稳定可能反映出生长变慢,但更有可能表明我们即将达到 XTT 检测的吸光度最大值,缩短试剂孵育时间以获得更多时间点。

图 2. 使用Biomek FX 工作站(左)对基质胶培养物进行铺板、处理和染色。然后用配备 MiniMax 细胞计数器的 SpectraMax i3X 读板机(中间)或 ImageXpress Micro 共聚焦系统(右图)分析。
由于 XTT 检测是一种终点检测,我们还试图以非标记方式追踪细胞生长。我们使用 SpectraMax
i3X 读板机,配备 SpectraMax MiniMax 300 成像细胞计数器(“MiniMax 细胞计数器”,Molecular Devices),用于测量被表面菌落占据的孔的百分比(“field”分析设置)。尽管平板基质胶的轻微凹面妨碍了平面的清晰,但随着时间的推移很容易检测到表面菌落融合度的变化(数据未显示)。更重要的是,这些培养物的菌落形态使得细胞数量翻倍可能不会融合度增加两倍。XTT 检测可提供更准确的细胞数量增加表现,但成像方法可作为合理的替代方法,以确保细胞生长稳定,同时允许细胞在未来继续用于实验。
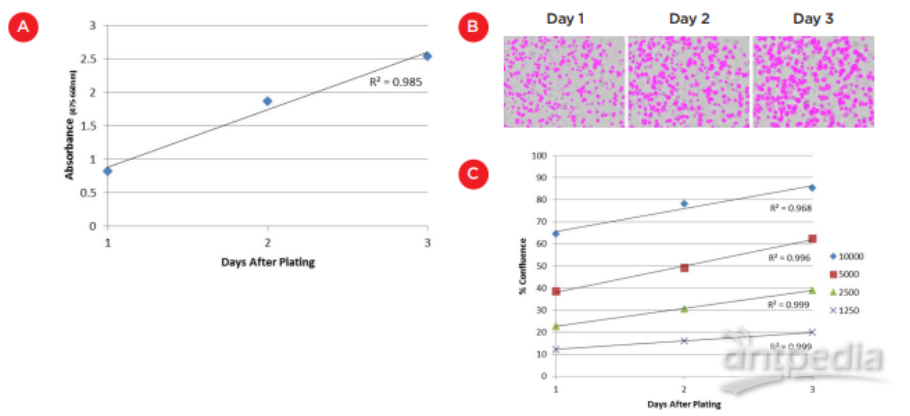
在对嵌入基质胶的培养物进行成像时,缺乏焦平面甚至更具挑战性。但是,我们能够使用在 MiniMax 细胞计数仪上进行场测量,以再次查看接受不同细胞接种的孔之间的差异 以及跟踪随时间推移的增长。图 3B 显示了在 MiniMax 细胞仪上采集和分析的孔图像以识别存在细胞的区域。人们可以看到,在三天的时间内,被识别的细胞数量不断增加。该图 3C 绘制了其他细胞铺板数的融合度水平。同样,虽然可能不是直接的测定细胞数量增加,但生长曲线中的高线性水平(R2 值在 0.968 至0.999),且接种细胞数量之间的清晰的区别表明这种方法可用于追踪以非标记方式包埋基质胶培养物。
图 3. 分析基质胶上/基质胶中的细胞生长。A) 对在三天内在基质胶表面生长的 8000 个细胞的 XTT 测定。
使用 XTT 试剂孵育 4 小时后,在 SpectraMax i3X 读板机上进行光吸收检测。B) Matrigel中HCT116细胞 的汇合度
使用带 MiniMax 细胞计数器的 SpectraMax i3X 读板机进行现场分析测量,。图像显示
在三天内增加 2500 个细胞的识别面积。C) 不同起始细胞数量的融合度测量图。
在最初三天培养中,所有细胞数量的融合度均呈高度线性(R2 0.968 至 0.999)。
化合物处理和凋亡分析
化合物稀释和添加
3D 培养的目标之一是确定细胞在更具生物相关性的系统中对刺激的反应。我们想确定在 Matrigel 中生长的结肠癌细胞如何对凋亡诱导剂作出反应。接种 HCT 116 细胞后 5 天将细胞凋亡诱导化合物用 NucBlue® Live ReadyProbes® 试剂(Thermo FisherScientific)稀释至以下浓度:10 μM 星孢菌素、20 μM 喜树碱和 375 μM5-氟尿嘧啶。化合物由于需要较长的孵育时间来对基质胶中的细胞核进行染色,因此在 NucBlue 中稀释。添加这些溶液至 96 孔圆底板的第一行,Span-8 移液器将含 1% DMSO 的 NucBlue 转移至板的剩余行。然后使用 EST 按 1:3 的顺序连续稀释化合物,留下最后一行作为阴性对照(仅 DMSO)。
从 100 μL 液体高度开始,从 Matrigel 孔中吸取 10 μL 培养基在抽吸过程中跟随液体液位。这不仅可以确保我们不会破坏基质胶,而且可以使由于蒸发(即边缘孔)导致的培养基损失回归至与板其余部分相同的体积,因为空气将被抽吸直至移液管尖端达到液体。此体积标准化可确保整添加 10 μL 化合物稀释液到复孔中后,整个板的化合物最终浓度准确。
凋亡检测
化合物处理 24 小时后,加入 10 μL CellEvent® Caspase-3/7 Green (Thermo Fisher Scientific) 并培养在 37°C 下孵育 6 小时以对凋亡细胞进行染色。使用 ImageXpress® Micro Confocal 共聚焦系统采集细胞图像高内涵成像系统(“ImageXpress Micro 共聚焦系统”,Molecular Devices,图 2)。孔在 DAPI 和 FITC 滤光片下进行 4X放大。这种较低的放大倍率允许对整个孔进行成像,并通过采集Z-stacks,我们能够在三维空间中可视化嵌入的细胞,如图 4A 所示。图 4B 显示了对每种诱导剂前 5 种稀释度的复孔所采集的 zstacks的二维投影。这些投影可用于计算埋于整个2 mm Matrigel 层中的总细胞(蓝色细胞核)和caspase阳新细胞(绿色)包,用于确定每种化合物诱导的凋亡的相对水平。
各浓度下caspase阳性细胞的百分比(两个复孔的平均值)如图 4C 所示。无论是星孢菌素还是喜树碱均达到最大毒性,并显示出传统的剂量反应曲线,从而允许计算包埋在基质胶中的 HCT 116 细胞的 IC50。ICIC50 为 6 nM 的星形孢菌素大约,对HCT 116 细胞的毒性比对喜树碱的高出10倍,后者 IC50 为 80 nM。5-氟尿嘧啶的作用要弱得多,而在 3.75 μM 的最大浓度达到了50%毒性,其任何 IC50 值都不可靠。这种5-氟尿嘧啶的检测较弱的效果也见于我们之前对 HCT 116 细胞 3D 模型的研究中。
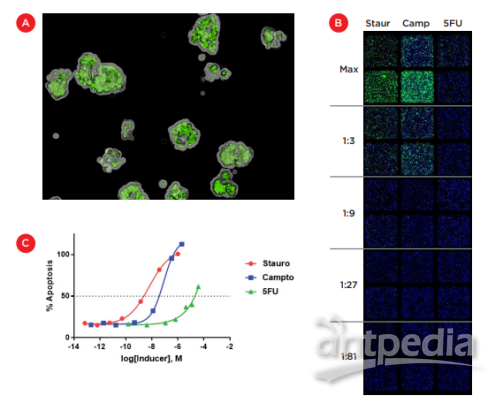
图 4. 诱导 Matrigel 包埋培养物的凋亡。A) 使用 ImageXpress Micro Confocal 共聚焦系统采集的图像展示了三维集落,
荧光caspase 3/7 底物作为凋亡的标记物。B) 使用 ImageXpress Micro Confocal 共聚焦系统以 4X放大倍率采集的 Z-stacks的2D投射后的拼图。用稀释的 staurosporine、喜树碱和 5-氟尿嘧啶(显示前 5 种稀释比例),并染色细胞核(蓝色)和凋亡(绿色)。C) 每种化合物的成像数据生的成剂量-反应曲线。
讨论
基质胶培养物对于许多研究都非常有价值。同时,我们演示了在 3D-培养的结肠癌细胞中诱导细胞凋亡的化合物筛选,Matrigel 还可应用到其他需要三维空间的检测,例如血管形成或神经突生长的研究。然而,使用 Matrigel 检测法的挑战是巨大的。我们已展示了精细控制的移液速度和位置以及温度调节如何使自动化克服了这些障碍。其中一个例子就是自动化如何使这些检测小型化为384孔板,与手动电镀或 96 孔板相比,384 孔板型的 Matrigel 使用量减少了 50%,从而节省了大量成本格式。这种更小的格式也需要更少的染色试剂,并可实现更快的共聚焦成像,因为对于96孔板拉私活捕获整孔的图像需要多个视野。
Biomek 工作站的灵活性还可实现多种的工作流程或通量。例如,我们执行了在单个 Peltier 位置加热 Matrigel 检测板,但如果需要同时处理大量板,可以集成额外的 Peltier 或培养箱。更高通量的应用还可通过集成板和枪头存储以及分像带 MiniMax 细胞计数仪的 SpectraMax i3X 读板机或 ImageXpress Micro Confocal 系统析仪。

