生物大分子X射线小角散射实验指南
导读:基于同步辐射的X射线小角散射实验可以实现高通量以及更高的分辨率和信噪比。本文简单介绍了生物大分子小角散射(BioSAXS)的数据收集策略以及样品准备要求,看完这篇就可以准备样品直接去BL19U2收集小角数据了!
BioSAXS的目标
生物分子的小角X射线散射(以下简称生物小角,Bio-SAXS)是以生物分子作为研究对象的小角X射线散射技术。生物大分子(蛋白质和核酸)的尺度正好处于纳米尺度,是小角散射研究的重要领域之一。
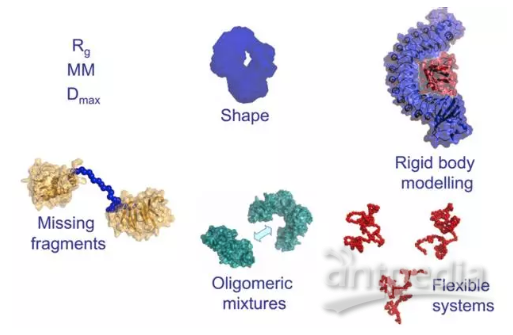
我们通过ATSAS程序组给出的一张图来看BioSAXS能够给出什么信息,解决什么问题。首先,散射信号可以给出分子的全局信息,比如大小尺寸(Rg,Dmax)、分子量;也可以通过Kratky图得到蛋白折叠程度的信息。随着计算技术的发展,可以通过第一性原理建模,利用虚拟原子搭建分子的三维模型,由于分辨率较低,大家一般称之为轮廓。对于复合物,当有各个部分的晶体结构存在,可以通过刚体建模构建复合物模型。还可以拟合出蛋白中缺失的loop区域。分析溶液中的蛋白的聚合状态,即不同寡聚体的比例。最后,对于具有内部柔性的蛋白(这类蛋白往往难以结晶),也可以通过系综筛选的方法得到一个溶液中的最优构象分布。
溶液散射的特点
生物大分子在溶液中,不像在晶体中是按照点阵排列的,因此散射信号在所有可能的空间取向上平均,最终得到的散射信号为一维曲线。晶体衍射中有几千乃至上万个点的强度信息,仍然会面临相位信息缺失的问题,小角散射信号可能只有几百个点的数据,对于分子结构而言,采样率远远不够。

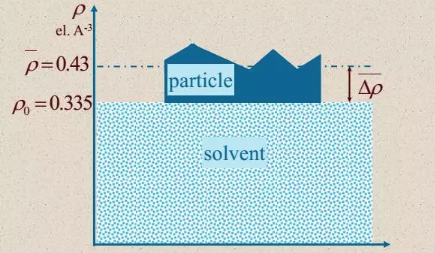
另一个方面,生物分子,特别是蛋白质与溶剂的电子密度差小,而SAXS测量的是电子密度的涨落,因此散射信号弱。不仅如此,散射信号来自溶液中所有分子的散射,当有多种组分存在,且结构都未知的话,几乎不可能得到有效的结构信息。下图中所示的粒子悬浮在溶剂中,粒子的散射信号需要扣减溶剂背景,如果所扣背景和溶剂成分存在差别,也会引起粒子散射信号的偏差。
最后,高强度的X光会在溶液中引起样品的辐射损伤。入射X射线与样品中的水分子的相互作用产生羟基或过氧自由基,自由基活化的蛋白倾向于通过共价和/或非共价键交联,从而诱导聚集。BioSAXS的样品是溶液,这也意味着它们不能像晶体那样被冷冻。解释受辐射效应影响的散射数据几乎是不可能的,因此必须尽量减少这些影响。
BioSAXS数据收集策略
SAS实验的基本目的是测量由于分离的大分子形成的散射。它们总是溶解在水溶液中,因此有必要从样品的测量散射曲线中减去溶剂或其它外来源的任何贡献。
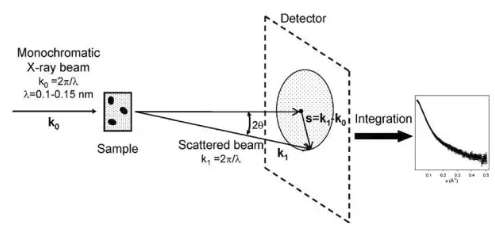
实验站的设置主要有以下四点(我们已经小心地做好了):
首先,探测器会带来电子噪声或暗电流,通过选用光子计数探测器并维持在一个合适的环境中(干燥加冷却,设置合适的能量预知)可以使得该项非常弱乃至可以忽略。
第二,光路中的杂散射,选用无散射狭缝并细致地调节狭缝组可以有效地降低光路中的寄生散射,减少空气段并维持较低的真空度也能有效降低背底。
第三,样品池的选择,X射线散射通常使用玻璃毛细管或使用云母作为窗口的样品池,需要小心地避开容器中的划痕。
第四,记录透射光强。不同的样品有不同的吸收值,从而影响被散射的光子数目。在top-up模式下,采用透射光强的比值来确定样品的入射光强。
然后,就是上样,打开光闸,收集数据(是不是还有点小激动)。同样需要注意四点:
第一,样品前后各收集一次缓冲液的数据,在保证溶液和溶剂的缓冲液组成完全匹配的情况下,这样做的好处是避免背景散射随时间的漂移。
第二,每个样品采用多次(例如,十或二十)曝光模式进行收集,记录的图案被单独处理并且彼此进行比较,显示出系统变化(主要是辐射损伤)的图案则不包括在随后的平均和进一步的数据处理中。
第三,对同一个样品收集多个浓度。推荐使用的样品浓度范围1-10 mg/ml ,对同一个蛋白样品至少测量三个浓度(如1、3、5……)。
第四,在同步辐射装置进行试验时,缓冲液中应该添加自由基清除剂以降低辐射损伤。常用试剂为 DTT (2-10 mM,推荐使用 2mM),TCEP (1-2mM),或 glycerol (~5%)。如果使用 DTT,记得防止其被空气氧化,可以在数据收集之前添加。
样品准备
样品其实是第一重要的。虽然任何样品都会给出散射信号,只有均一性好的样品才能给出可以分析的数据!
首先,选择合适的缓冲液成分可以帮助最小化样品聚合和降低辐射损伤 :a、盐浓度少于 500 mM;b、推荐使用 HEPES 或 TRIS 组分的缓冲液,在没有使用自由基清除剂的情况下, HEPES 或 TRIS 也可以成为自由基清除剂。
其次,确保缓冲液与蛋白溶液匹配:a、最好取蛋白透析过程的透析液作为对照缓冲液,推荐长时间(16-48 小时)透析的透析液。 b、若受样品稳定性或准备时间的限制,不方便进行透析操作。可选用合适分子量的浓缩管对缓冲液进行高速离心。c、缓冲液最好进行真空/超声脱气以避免数据收集时形成气泡。d、样品透析之前,先用 0.22um 的膜进行过滤。
再次,确认样品纯度以及聚合状态: 可以使用的方法包括 SDS PAGE,本体凝胶过滤(native gel filter),动态光散射(DLS),分析超速离心及 FPLC。确保测量系统为一个单分散体系。
最后,确定样品浓度:对大部分蛋白样品使用 OD280,DNA 使用 OD260。