南京大学刘震团队:scPISA用于活细胞低拷贝数蛋白质分析
细胞是生物体结构和生命活动的基本单位,基于细胞的研究是生命科学的基础。然而,由于细胞体积极小,一些重要组分含量极低,细胞微环境的复杂性等等因素使得单细胞分析成为一项十分具有挑战性的工作。通常的生命科学研究主要以大量细胞为研究对象,但是,这种细胞群体水平的分析掩盖了细胞个体间存在的显著微观不均一性,因而难以反映出单细胞水平真实的生命活动规律。因此,基于单细胞分析的生命科学研究能够从更深的层次上揭示生命活动的本质和规律,为探究重大疾病的起因、发展和治疗提供更可靠的科学依据。
蛋白质是生物学功能的直接执行分子,近年来,越来越多的研究表明除了基因突变外,蛋白质的异常也与癌症的发生发展密切相关。低拷贝数蛋白质,是指在单个细胞内分子数目少于1000个拷贝数的蛋白质,虽然这些蛋白质的丰度极低,但是它们在多种重要的生物学过程中起着关键的调控作用。纵观整个单细胞分析技术领域,蛋白质的分析手段远远滞后于基因组和转录组的分析方法,其最根本的原因是蛋白质的研究缺少类似于PCR的扩增工具,导致很多低丰度的蛋白质在检测方面巨大的挑战。因此,发展适用于单细胞内低拷贝数蛋白质的检测技术具有重要的科学意义和应用价值。
我校化学化工学院生命分析化学国家重点实验室刘震教授团队将免疫识别与等离激元拉曼检测技术相结合,创新性地发展了一种等离激元免疫夹心法(Plasmonic immunosandwich assays, PISA),成功实现了单个活细胞及活体动物内多种低拷贝数蛋白质的分析(Angewandte Chemie International Edition, 2016, 55, 13215)。此后,该方法还扩展到单个活细胞中的microRNA的分析(Chemical Science, 2018, 9, 7241)以及基于生理样品中的蛋白质和microRNA标志物的疾病诊断分析(Analytical Chemistry, 2016, 88, 12363;Analytical Chemistry, 2019, 2019, 91, 4831;Analytical Chemistry, 2019, 91, 9993;Biosensors and Bioelectronics, 2019, 145, 111729)。同时,该技术还被成功应用于单细胞信号通路研究和抗癌药物活性评价(Analytical Chemistry, 2020, 92, 12498)等应用。单细胞等离激元免疫夹心法(scPISA)的工作流程示意图如图1所示。该方法的原理为:亲和配基功能化的金基微萃取探针(尖端约0.5-1微米)在显微操作系统的控制下,准确地插入单个活细胞内特定部位进行目标蛋白的富集,萃取一定的时间后,将微萃取探针从细胞内拔出,经过适当的清洗步骤降低微萃取探针表面的非特异性吸附,再用亲和配基功能化的银基纳米拉曼标签对富集到的目标蛋白质进行标记,从而在微萃取探针表面形成类似三明治夹心结构的微萃取探针-目标蛋白质-纳米拉曼标签免疫复合物,当激光照射在该免疫复合物的表面,金基微萃取探针和银基纳米拉曼标签之间纳米级间隙内由于等离激元耦合作用产生 “热点”,显著地增强纳米标签的表面增强拉曼散射(SERS)信号,灵敏度达单分子水平,从而能够实现低拷贝数生物分子的检测。另一方面,基于抗体或人工抗体(包括分子印迹聚合物和核酸适配体)的免疫微萃取以及免疫三明治夹心复合物的技术路径充分能保证检测的专一性。
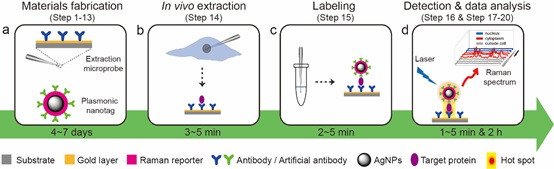
图1. 单细胞等离激元免疫夹心法的工作示意图

图2. 该方法所用的仪器平台
与现有的单细胞蛋白质分析技术相比,scPISA具有以下明显的优势:首先,超高的检测灵敏度(单分子水平),实现低丰度生物分子的检测;其次,对目标蛋白质识别的高特异性,保证方法可以应用于复杂的细胞微环境;第三,分析速度快,从活体萃取到拉曼信号的读出仅需要约6-15分钟;scPISA是一项微创的技术,经过萃取后细胞仍能存活,可以继续用于后续研究,该特点在发育生物学及精准医学领域具有重要的应用价值。此外,scPISA还具有普适性,除了用于蛋白质的分析,还可以用于核酸等其他生物物种的分析,只需要选择相应的亲和配基制备具有靶向识别性能的功能化微探针和纳米标记标签即可。
通过单细胞等离激元免疫夹心法,研究人员获得了单个活细胞中多种低拷贝数蛋白质的诸多重要分子信息,例如低拷贝数蛋白质在单细胞内的表达水平、亚细胞分布等等。这些关键信息不仅从分子水平揭示了细胞内蛋白质表达和分布的异质性,也为多种生物学过程以及蛋白相关疾病的发生发展提供了重要信息。在此基础上,该团队将该技术应用于单细胞信号通路研究,建立了具有亚细胞分辨率的关键信号蛋白及其复合物的测定和多元检测等方法。该方法有望信号通路研究、为精准药效评价和个性化药物筛选等重要应用领域提供新颖可靠的研究手段。
2021年6月5日, Nature子刊Nature Protocols在线发表了我校刘震教授团队在单细胞低拷贝数蛋白质分析的重要研究工作“Probing low-copy-number proteins in single living cells using single-cell plasmonic immunosandwich assays” (https://doi.org/10.1038/s41596-021-00547-9)。该论文的第一作者是刘佳博士,刘震教授为论文的通讯作者。贺晖、谢丹和温艳蓉为共同作者。该工作得到国家自然科学基金重大科研仪器研制项目和南京大学卓越计划的资助。
论文信息:
https://www.nature.com/articles/s41596-021-00547-9
Probing low-copy-number proteins in single living cells using single-cell plasmonic immunosandwich assays
Jia Liu, Hui He, Dan Xie, Yanrong Wen, Zhen Liu*
Nature Protocols, 2021, DOI: https://doi.org/10.1038/s41596-021-00547-9