不同分子量蛋白质的分离——凝胶管柱层析法
实验原理
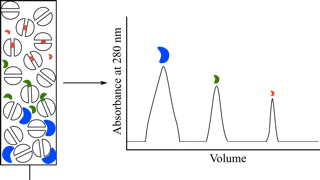
凝胶层析又称凝胶过滤,是一种按分子量大小分离物质的层析方法。该方法是把样品加到充满着凝胶颗粒的层析柱中,然后用缓冲液洗脱。大分子不能进入凝胶颗粒中的静止相中,只留在凝胶颗粒之间的流动相中,因此以较快的速度首先流出层析柱,而小分子则能自由出入凝胶颗粒中,并很快在流动相和静止相之间形成动态平衡,因此就要花费较长的时间流经柱床,从而使不同大小的分子得以分离。
凝胶过滤柱层析所用的基质是具有立体网状结构、筛孔直径一致,且呈珠状颗粒的物质。这种物质可以完全或部分排阻某些大分子化合物于筛孔之外,而对某些小分子化合物则不能排阻,但可让其在筛孔中自由扩散、渗透。任何一种被分离的化合物被凝胶筛孔排阻的程度可用分配系数
Kav(被分离化合物在内水和外水体积中的比例关系)表示。Kav值的大小与凝胶床的总体积(Vt)、外水体积(Vo)及分离物本身的洗脱体积(Ve)有关,即:
Kav= (Ve-Vo)/(Vt-Vo)
在限定的层析条件下,Vt和Vo都是恒定值,而Ve值却是随着分离物分子量的变化而变化的。分离物分子量大,Kav值小;反之,则Kav值增大。
通常选用蓝色葡聚糖2000作为测定外水体积的物质。该物质分子量大(为200万),呈蓝色,它在各种型号的葡聚糖凝胶中都被完全排阻,并可借助其本身颜色,采用肉眼或分光光度仪检测(210nm或260nm或620nm)洗脱体积(即Vo)。但是,在测定激酶等蛋白质的分子量时,宜用蓝色葡聚糖2000测定外水体积,因为它对激酶有吸附作用,所以有时用巨球蛋白代替。测定内水体积(Vi)的物质,可选用硫酸铵、
N-乙酰酪氨酸乙酯,或者其它与凝胶无吸附力的小分子物质。
本实验使用血红蛋白(分子量64,500左右)和二硝基氟苯-鱼精蛋白(DNP-鱼精蛋白分子量12,000左右)的混合物,通过Sephadex G-25层析后达到分离。
试剂和器材
一、试剂
0.9% NaCl;10% NaHCO3);95%乙醇。
pH 7.0凝酸缓冲液(20mM磷酸二氢钠:20mM磷酸氢二钠=31mL:69mL)
二、材料
血红蛋白溶液(Hb):取抗凝血(肝素)2mL,离心弃去上层血浆。用0.9%NaCl洗血细胞数次(颠倒混匀,离心,弃去上清液),使离心后上清液几乎无淡黄色为止。于洗净的红细胞中加入5倍体积的蒸馏水摇匀,离心去沉淀(破碎的细胞膜等)即为Hb稀释液备用。
DNP-鱼精蛋白溶液:取鱼精蛋白0.15g溶于10%NaHCO3溶液1.5mL中(此时该蛋白质溶液pH应在
8.5~9.0左右)。另取二硝基氟苯0.15g,溶于微热的95%乙醇3mL中,待其充分溶解后立即倾入上述蛋白质溶液中。将此管置于沸水浴中煮沸5分钟,注意防止乙醇沸腾溢出。冷却后加2倍体积的95%乙醇,可见黄色的DNP-鱼精蛋白沉淀。离心(300r/m)5分钟,弃去上清液,沉淀用95%乙醇洗2次,所得沉淀用1mL蒸馏水溶解,即为DNP-鱼精蛋白溶液,备用。
三、器材
层析柱(1′15cm);吸管1mL(′1);滴管;搅棒试管
操作方法
一、凝胶的溶胀
取3克葡聚糖凝胶(Sephadex G-25)干粉,浸泡于蒸馏水中充分溶胀(室温6小时),或者于沸水浴中煮沸1小时后冷却。充分溶胀后的凝胶以倾斜法除去表面悬浮的小颗粒,如此反复洗涤 2~3次,最后加入等体积pH7.0磷酸缓冲液备用。
二、装柱
取直径1cm,长15cm的玻璃层析柱,垂直固定在铁架台上,将层析柱下端的止水螺丝旋紧,向柱中加入约
5-7cm高的磷酸缓冲液,调节流速1滴/10秒;待柱中剩下约0.5cm磷酸缓冲液时,关掉恒流泵,把溶胀好的糊状凝胶一次性倒入柱中,自然沉降20分钟,在此过程中可以看到凝胶均匀地沉降到柱的底部并不断地上升。20分钟后,用镊子小心在胶面上放置圆片滤纸,用滴管补加缓冲液(注意随时添加缓冲液,防止柱床干裂)。同时开启恒流泵,控制一定的流速,使柱中的凝胶一直处在溶液中。若分次装入凝胶,需用玻璃棒轻轻搅动柱床上层凝胶,以免出现界面分层。装柱长度至少10cm。
三、平衡
用磷酸缓冲液冲洗洗脱,平衡20分钟。注意在任何时候不要使液面低于凝胶表面,否则可能有气泡混入,影响液体在柱内的流动。
四、样品制备
取DNP-鱼精蛋白溶液3滴和Hb溶液1滴混合,即为上柱样品。
五、上样
待层析柱上缓冲液几乎全部进入凝胶时,关掉恒流泵,用滴管将上述样品沿柱内壁小心加到床表面,注意尽量不使平整的床表面搅动,然后打开恒流泵,让样品进入柱床。待其将进入柱床时,关掉恒流泵,用滴管小心加入磷酸缓冲液至柱顶。
六、洗脱
旋紧柱顶,将进液管接入洗脱液瓶中,用缓冲液进行洗脱,控制缓冲液在约每10秒一滴的流速,观察并记录Hb和 DNP-鱼精蛋白在层析柱中的位置,并解释之。
待所有有色条带完全流出柱子后,继续洗柱5 min。停止恒流泵,卸下柱子,旋下柱顶螺旋,将凝胶倒回小烧杯中并取出滤纸片。
注意事项
(1)根据层析柱的容积和所选用的凝胶溶胀后柱床容积,计算所需凝胶干粉的重量,用洗脱缓冲液使其充分溶胀。
(2)层析柱粗细必须均匀,柱管大小可根据试剂需要选择。一般来说,细长的柱分离效果较好。若样品量多,最好选用内径较粗的柱,但此时分离效果稍差。柱管内径太小时,会发生“管壁效应”,即柱管中心部分的组份移动慢,而管壁周围的移动快。柱越长,分离效果越好,但柱过长,实验时间长,样品稀释度大,分离效果反而不好。
(3)各接头不漏气,连接用的小乳胶管不要有破损,否则造成漏气、漏液。
(4)装柱要均匀,不要过松也不要过紧,最好也在要求的操作压下装柱,流速不宜过快,避免因此而压紧凝胶。但也不要过慢,使柱装得太松,导致层析过程中,凝胶床高度下降。
(5)始终保持柱内液面高于凝胶表面,否则水分挥发,凝胶变干。