凝胶层析法脱盐和分离蛋白质(附凝胶过滤法原理及...-3
凝胶层析法脱盐和分离蛋白质(附凝胶过滤法原理及基本操作)-3
(2)装柱将层析剂装入柱中进行层析的方法称柱层析法。作层析用的柱子称层析柱。层析柱有玻璃和透明塑料的两种。柱子的一端为进口,另一端为出口,出口端底部有烧结玻璃砂板或尼龙布,能阻止层析剂流出,溶剂则可流过。如果没有市售的层析柱,可以选用粗细均匀,长短合适的玻璃管,在两端塞上合适的胶塞,胶塞中插人细玻璃管,在一端放一层尼龙布为出口,即可作为层析柱使用。层析柱的长短粗细根据实验的目的而定,一般说来,凝胶层析时柱越长,分离效果越好。但柱过长,层析时间长,样品易稀释造成扩散,反而影响分离效果。柱的内径不宜较细,直径1cm以下的柱易发生“管壁效应”,即柱中部分的物质组分移动较快,管壁周围的则移动较慢,造成分离混乱。当然柱的内径也不宜过粗。
凝胶层析中,在把小分子物质(mw<1 500),如无机或其他物质与大分子物质 (mw<20
000)分离时,层析柱的体积一般约为样品的4–10倍,高度与直径的比例为5:1至15:1之间。这类柱也称为“脱盐”柱,常用网孔很小的凝胶如G–25。用以将生物大分子物质彼此分开的分级层析柱,体积应为样品体积的25~100倍。柱长度与直径的比例为20:1~100:1。
装柱的操作过程如下:将层析柱垂直固定在支架上,打开柱下口开关。将溶胀好的凝胶放在烧杯中,使凝胶表面上的水层与凝胶体积相等。用玻璃棒搅匀凝胶液,顺玻璃棒灌入柱内。此时柱下口一边排水,上口一边加入搅匀的凝胶,可见凝胶连续均匀地沉降,逐步形成凝胶柱。当到达所需凝胶柱高度时,立即关闭下口,待凝胶自然沉降形成凝胶柱床。凝胶柱床一般应离柱顶3~5cm,并覆盖一层溶液。
灌注凝胶时要求将均匀的凝胶一直加到所需柱床高度,不能时断时续,否则将出现分层或“纹路”等毛病。若中途出现这些现象,可以用玻璃棒将已形成的柱床逐步搅起,直至出毛病的部分再让凝胶重新沉降或继续加入搅匀的凝胶悬液。若在灌好胶后才发现“纹路”、分层等现象时,要重新装柱,以免影响层析效果。在做大型的凝胶柱时,灌注的凝胶是否均匀往往从表面上看不出来。所以使用前应该用一些带色的大分子物质如细胞色素C、血红蛋白或专用的蓝色葡聚糖–2
000 (Blue dextran–2 000)通过凝胶柱,观察形成的色斑带是否整齐,若斑带歪斜,应该重新装柱,直至达到要求。
刚从冰箱中取出的凝胶液,不能马上用来灌柱,应平衡至室温后再用,不然装好的凝胶会产生大量的气泡影响层析。
在整个灌注凝胶的过程及使用中,凝胶柱面上一定要覆盖着一层溶液,以免进入空气。若进空气再加入溶液时,凝胶柱中易形成气泡。
(3)平衡装好的凝胶柱,使用前应该用相当于柱床体积两倍或更多的洗脱液流过凝胶柱,以压实凝胶,称为平衡。
(4)上样将样品加入到凝胶柱中,准备层析的过程称上样。上样时,应该注意上样量的多少、样品的黏稠度及离子强度。这三个因素会影响到以后层析的效果。一般来说“脱盐”层析时,上样体积可为柱体积的10%~25%;生物大分子的分级分离,约为柱体积的1%~5%。样品的黏稠度一般不宜大于洗脱液黏稠度的2倍以上,不然洗脱峰会变宽和歪斜。离子强度要达到0.08,以免产生特异性吸附。
上样操作:先打开层析柱的下口开关,放出凝胶柱面上的溶液,或用皮头吸管吸取,使液面与凝胶表面相平齐,但切忌液面低于凝胶表面。然后将样品加在凝胶表面,打开柱下口开关,控制流速,使样品慢慢渗入凝胶内。加样时注意勿将凝胶柱面冲起形成凹面,也不能沿管壁流下,以免样品沿柱壁与凝胶柱的间凝胶隙漏下。当慢慢渗入凝胶的样品液液面与凝胶柱面相平时,关闭下口,完成上样。然后在凝胶柱面上加一层(3~5cm)洗脱液,接上洗脱瓶准备洗脱。
(5)洗脱用规定的溶液流过样品,使分子量不同的样品逐步分开并先后由柱床流出的过程称为洗脱。所用溶液称洗脱液。洗脱液放在贮液瓶(洗脱瓶)中并与层析柱相通连。洗脱时只要打开层析柱下口开关,洗脱液即可流出。
洗脱过程中保持恒定的流速是柱层析获得良好分离效果的重要条件。因为凝胶层析的分离作用主要取决于分子扩散进入凝胶的机会,流速过快有些分子来不及在分子筛中分配而流出;过慢时已分离的分子会因扩散而混合。因而要保持适当的恒定流速。洗脱液的流速取决于它的静水压。静水压是指洗脱瓶中洗脱液的液面高出于层析柱出口产生的液体压力(或接触空气的两个液面间的高差),这个高度差越大,静水压越大,洗脱液的流速就越快。这个压力差可以调动,如提高洗脱瓶的位置或瓶中液面的增减;或者降低或提高层析柱出口的位置等,因此静水压又称操作压。
由于静水压越大,洗脱液的流速就越快。在固定洗脱瓶与出口位置的情况下,静水压会在洗脱过程中,随着洗脱瓶中溶液减少液面不断下降而减少,难以维持流速的恒定。为了解决这个问题,Marriotte首次将洗脱瓶加塞塞紧,塞中插入玻璃管,使玻管下口深入到洗脱液的底部,这样洗脱液的静水压便等于此玻管下口的液面高出层析柱出口液面的高度(因为当洗脱瓶液体流出时,瓶顶形成真空,空气只从玻璃管中进入,玻管下口即为接触空气点),因此只要溶液不低于玻璃管下口,玻璃管口以上溶液的增减将不影响静水压,从而自动保持了流速的恒定,此洗脱瓶称为恒压瓶,也叫马氏瓶。当然,当洗脱液减少至液面低于玻管的下口时,便会失去作用,但这时可用及时加入洗脱液来解决。
在凝胶层析中,不仅要保持静水压的恒定,还要保持适当的静水压。这是因为G–75以上的软胶胶体柔软易变形,对静水压仅有一定的承受能力,不同软胶的承受能力也不相同,静水压超过凝胶的承受能力时,最初流速会很快;其后随着静水压力过大将使软胶变形压紧,流速逐渐降低,最后甚至流不出。所以,保持恒定正确的静水压是凝胶层析时获得满意结果的必要条件。
脱盐一般使用的是G–25属于硬胶,硬胶不易变形,受静水压的影响较小,实验过程中的流速可用恒压瓶下口橡皮管上的螺旋夹控制在0.5ml/min左右,随着洗脱液的流出,样品逐步被分开。用试管收集洗脱液,按顺序每管收集2ml。
(6)检测
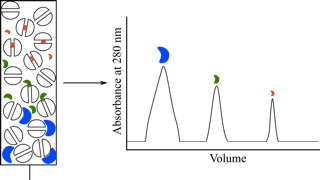
在收集的同时,检查蛋白质是否流出。于每管中取出1滴放在黑色比色板孔中(按编号顺序),再分别加入1滴20%磺酰水扬酸,如出现白色沉淀即表示蛋白质已流出凝胶柱,如此一直检查到蛋白质全流出为止。与此同时,再从蛋白质的管中取出1滴于白色比板中,加入奈氏试剂1滴,如蛋白管中不出现棕色,即表示蛋白质中的硫酸铵已除去。合并纯化后的蛋白质管以待用。以光密度值为纵坐标,以收集管的顺序号为横坐标,在坐标纸上绘图。可获具有一条洗脱峰的曲线,称为洗脱曲线,用以表示被分离物质流出的状态。
(7)凝胶的洗涤及保存由于凝胶对被分离的物质基本无吸附作用,所以无需“再生”,只要用洗脱液冲洗后即可连续使用。但因多次使用凝胶颗粒将逐渐沉积压紧,流速将减慢,所以使用一段时间后应倒出来,清洗后重新装柱。
凝胶暂时不使用可浸泡在溶液中,存放在4℃冰箱中。若放在室温保存应加入0.02%叠氮钠(NaN3)或0.01%乙酸汞等防腐剂,以防发霉。用时以水洗去防腐剂即可使用。凝胶长期不用,可用水洗净,分次加入百分浓度递增的乙醇溶液,每次停留一段时间,使之平衡,再换一下浓度的乙醇,让凝胶逐步脱水,再用乙醚除乙醇,抽干即可,或将凝胶洗净后抽干,在表面皿上30℃逐步烘干。