小鼠精原干细胞移植
实验概要
小鼠精原干细胞移植
主要试剂
75%乙醇、台盼蓝、白消安、水合氯醛
主要设备
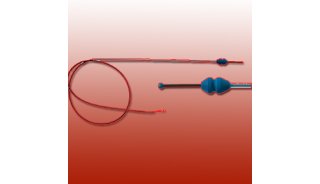
外科手术刀、外科手术剪、玻璃针(内径约40μm)、显微镊、实体解剖镜、相差显微镜、显微操作仪
实验步骤
(1)白消安处理受体鼠
取6~8周龄的小鼠,按照40~60 mg/kg腹腔注射白消安,小鼠在注射白消安4~6周后,可以用来移植。
(2)小鼠睾丸输出小管移植
①麻醉小鼠:小鼠腹腔注射水合氯醛300-400 mg/kg。约3~5 min后小鼠昏迷,用胶带固定小鼠四肢于显微操作仪平台上。
②调节显微操作仪的操作臂,将玻璃针(内径约40μm)尾部用打火机熏烤一下,装进操作臂内,旋好固定旋钮。
③备皮:剪去小鼠腹部的毛,然后用75%酒精棉球消毒小鼠腹部皮肤。
④开腹:逐层从表皮至肌层打开腹腔。沿小鼠腹中线开口可以避免出血,如果出血过多可以用止血钳止血后再操作。
⑤将睾丸拉出腹腔:于膀胱旁边寻找与睾丸相连的脂肪垫,轻轻拖出腹腔,小鼠的睾丸和附睾顺势被拖出腹腔。
⑥调节实体解剖镜光源的亮度及放大倍数(尽量≤2倍)至镜下小鼠睾丸较清楚方可。
⑦用显微镊找出输出小管(连接睾丸网和附睾头部的一条透明管腔),并调整平台使小鼠输出小管的方向大约与玻璃针方向平行。
⑧双手持显微镊夹起输出小管,将其中一端套入玻璃针头部,并顺势平行将输出管向玻璃针方向移动。
⑨左手固定输出小管位置,右手旋动进液旋钮,将细胞注射进输出小管内,供体细胞悬液的密度为1~10 ×107/mL,注射的细胞悬液中含有0.004%台盼蓝,细胞悬液约充盈70%~80%曲细精管,一般不超过10 μl。
⑩注射结束后将睾丸及脂肪垫等顺势小心送入腹腔,切勿使睾丸扭转,然后逐层关腹,最后将酒精棉敷于小鼠腹部防止感染,将小鼠置于温暖处,待其苏醒后放回饲养室。
(3)移植后观察小鼠生精恢复情况
①移植1 w、4 w、8 w后,分别手术摘取受体小鼠睾丸,在DPBS中用剪刀镊子去除睾丸白膜,将曲细精管分离出来后进行冰冻切片染色观察移植细胞的位置及生殖细胞标记的表达情况进而观察细胞存活及沉底情况。
②移植3个月后,将受体小鼠与正常的成年雌鼠合笼,使其自然交配,次日检查雌鼠阴道栓。
③合笼19天后,每天观察产仔情况。可通过观察所产仔鼠毛色(注射及交配时注意品系毛色的选择)。