化学抑制剂可暂时抑制供体SSC分化恢复宿主的繁殖力
组织干细胞可恢复移植后宿主组织的结构和功能受损。在血液中,造血干细胞移植被确立为白血病的根治性治疗,从这一开创性研究开始,人们一直重视基于移植后再生能力来确定干细胞潜能,目前正在进行测试间充质和上皮组织干细胞移植可行性的试验。在小鼠精子发生中,干细胞移植已被用于干细胞潜能的定量和功能评估,然而,我们对单个精原干细胞(spermatogonial stem cells, SSCs)及其后代在移植后命运行为的了解仍然模糊,也因此限制了开发新策略以提高当前低移植效率的潜力。
近日,来自日本NINS的Shosei Yoshida团队在Cell Stem Cell杂志上发表了一篇题为“Transient suppression of transplanted spermatogonial stem cell differentiation restores fertility in mice”的文章。这项研究通过量化长期(长达180天)移植的GFRa1+和Ngn3+精原细胞的克隆命运,确定移植后供体精原干细胞的动态变化。在对克隆动态进行定量分析的基础上,研究人员进一步开发并应用一种策略,通过使用化学抑制剂暂时抑制供体SSC分化来恢复宿主的繁殖力。

在小鼠中,SSC潜能主要局限于一小部分未分化精原细胞(Aundiff),Aundiff在其形态、基因表达和体内行为中显示出异质性组成。为了确定在移植后恢复精子发生的SSC的身份并确定其在再繁殖期间的动态,作者首先对成年小鼠的宿主睾丸中的供体Aundiff进行了定量克隆命运分析(见图1),尽管发现GFRα1+和Ngn3+这两种细胞能在宿主精小管中定居,但绝大多数产生的克隆会随之消失(移植后第一周)。由于SSC需要一个多月的时间才能完全分化并离开小管,因此这些克隆消失一定与细胞死亡相关。对移植后供体细胞组分变化的量化结果显示,从Ngn3+状态转化的GFRα1+细胞在移植后作为真正的GFRα1+细胞发挥作用。在这里,我们需要提前了解,Aundiff的GFRα1+部分构成了自我更新池的大部分,同时产生了分化启动的Ngn3+;而Ngn3+细胞很少自我更新,而是以依赖于维甲酸(RA)信号的方式分化为Kit+精原细胞,部分有可能可逆地过渡到GFRα1+状态,在组织损伤后的恢复中起着至关重要的作用(见图1A)。
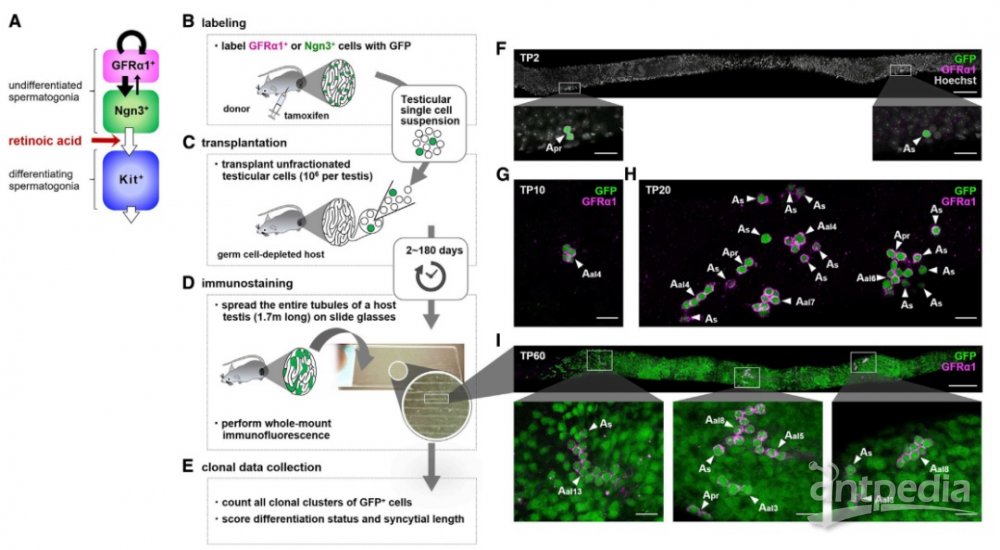
图1. 脉冲移植实验示意图
为了进一步阐明移植精原细胞的不同命运行为,作者进一步在宿主睾丸中进行活体成像分析,观察到在移植后供体精原细胞并未进行完全分裂,而是在分离和合胞状态之间不断转换,同时表现出频繁的细胞死亡。随后作者基于先前研究建立的可以定量捕获克隆命运行为的模型,并基于活体成像的不完全分裂率测量值,调整四个拟合参数(合胞体分裂和细胞丢失的有效率、GFRα1+细胞室发生细胞丢失的时间以及GFRα1-细胞的有效增殖率)后,根据优化模型得出的结论,作者认为在初始活跃阶段阻断供体细胞的分化可能会扩大SSC细胞群规模,从而导致长期持续生存的可能性增加。
Ngn3+向Kit+分化精原细胞的分化是一个由RA信号驱动的过程(见图1A),于是作者使用睾丸RA合成有效化学抑制剂Win18446(WIN)来证明上述猜想。有趣的是,作者发现WIN有效地阻止了Aundiff的分化,同时也观察到GFRα1+细胞的增加,表明GFRα1–细胞向GFRα1+状态的反向转化增强。更为重要的是,WIN处理介导的未分化细胞池的扩大有效地提高了每个克隆长期存活的可能性,进一步支持克隆在获得GFRα1+细胞后变得稳定的结论。
最后,作者评估了在移植后经WIN处理对宿主生育能力的影响。作者使用UBI-EGFP小鼠作为供体,与上述观察一致,WIN处理的宿主中长期重新繁殖的克隆数量大量增加。12只接受WIN治疗的宿主中有5只通过与正常雌性小鼠自然交配获得正常产仔数的供体细胞衍生(GFP+)后代。相反,DMSO处理的对照组没有产生后代。此外,来自WIN处理的宿主雄性的后代表现出正常的生长和生育能力。
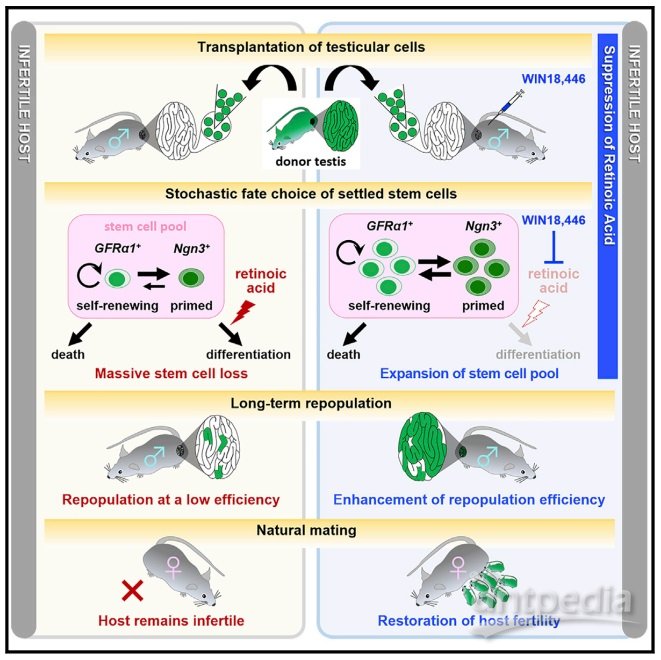
总的来说,这项研究以单细胞分辨率分析了供体小鼠SSC的命运,证实了使用RA合成化学抑制剂暂时抑制供体SSC分化来恢复宿主及其后代生育能力的策略,揭示了精原细胞移植在从癌症患者的生育能力恢复到生物多样性保护的一系列潜在应用。
-
项目成果









