强碱滴定弱酸的基本原理
强碱滴定弱酸
滴定反应为:

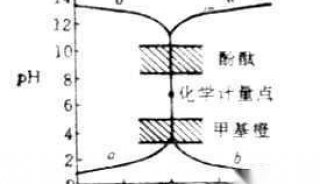
以NaOH液(0.1000moL/L滴定20.00ml醋酸(HAc,0.1000mol/L)为例,滴定曲线如图2:
滴定开始前 pH=2.88
滴入NaOH 液19.98ml时 pH=7.75
化学计量点时 pH=8.73
滴入NaOH液20.02ml时 pH=9.70
从滴定曲线可以看出:
(1)只能选择碱性指示剂(酚酞或百里酚酞等),不能选用酸性范围内变色的指示剂(如甲基橙、甲基红等)。因为突跃范围较小,pH值在7.75~9.70之间;计量点在碱性区。
(2)弱酸被准确滴定的判决是C·Ka>10-8。因为Ka愈大,突跃范围愈大。而Ka<10-8时,已没有明显突跃,无法用指示剂来确定终点;另外,酸的浓度愈大,突跃范围也愈大。
推荐
-
技术原理