Cell Metabolism | 医学的第四维——生物节律
众所周知,2017 诺贝尔生理或医学奖颁发给了三位美国遗传学家杰弗里·霍尔(Jeffrey C. Hall)、迈克尔·罗斯巴什(Michael Rosbash),以及迈克尔·杨(Michael W. Young),以表彰他们在发现果蝇生物节律分子机制方面的贡献。而在此前,医学界真正将生物节律——作为第四维度的时间——考虑在疾病治疗的临床应用却并不广泛,它的重要性似乎一直被科学家和医生有所忽略。随着近些年来的研究和发现,生物节律正在成为提高药物疗效和减少药物毒性的关键因素。事实上,已经有很多研究证据表明,某些药物在不同的时间用药的药效大不相同,有些适合白天用药,有些在夜晚则比在白天更有效。这表明,靶细胞的生物学规律将决定组织器官一天的特定时间对药物的反应,从而调节药效。因此,生物节律的时间因素是时候成为转化医学研究中不可或缺的一部分了。
近日,瑞典Karolinska Institutet的Barbara Canlon教授在Cell Metabolism杂志上发表观点文章Medicine in the Fourth Dimension,讨论了疾病与生物节律的关系。其中Michael Rosbash与Michael Young也是该文章的合作者。

一、人日夜节律的差异
过去几十年,尽管科学家对于模式生物中的生物钟分子机制有了很深的认识,但是生物节律基础研究与临床应用之间还有很长的距离。要想跨越基础研究和临床之间的这条鸿沟,就必须要在医疗实践中整合昼夜节律生物学元素【1】。
许多研究表明,生物节律对于疾病的影响十分重大。例如,许多研究表明心脏病在早晨发生的概率更大,其原因可能是由于心血管的日/夜波动,如受血压和心率的昼夜变化所影响【2-5】。还有研究表明,心脏手术等对身体伤害严重程度受时间的影响也比较大。具体而言,与早晨相比,下午进行手术的风险显著降低【6】。同样对啮齿动物的研究也证明了这种现象的存在。有趣的是,在心肌细胞生物钟被破坏的动物中,啮齿动物心脏损伤的昼/夜波动就会不存在【7】。此外,在医院的环境中,生物节律过程会被一些在白天或夜晚的常规活动中断,包括照明、药物唤醒、夜间肠外营养的递送(包括与日常食欲和消化周期不同的阶段),以及与药物代谢酶表达同步的药物输送。这些事件中的每一个都代表着内部和外部时间之间的冲突。类似地,熬夜或用蓝光屏阅读可能使固有的昼夜节律周期与自然光周期失去同步【8】。随着年龄的增长,这种情况导致神经退行性等的患病风险大大增加【9】。
昼夜节律病理迹象包括在特定时间出现的异常状况,例如夜间哮喘【10】和黎明时的葡萄糖峰值【11】。我们肯定比较熟悉的是,在学习认知上也存在时间变化,也有足够多的证据证明这些现象,比如认知上存在的昼夜控制【12】、记忆力【13】和情绪变化【14】在不同时间段的表现不一样。
此外,不同的工作时间和工作状态也与某些特定疾病风险增加相关,包括代谢、心血管、炎症和肿瘤疾病【15】。轮班制工作会导致昼夜节律混乱,引起精神状态紊乱和一些不良的习惯,如压力增加、进食习惯改变、吸烟、情绪变得容易焦虑或不稳定。抑郁症是与生理钟紊乱相关的疾病之一,表现为深度睡眠障碍和清晨早醒等【16】。这种现象是由节律功能障碍引起的:“睡眠—觉醒”周期紊乱是严重抑郁症的主要症状,睡眠障碍反过来又是导致抑郁症和其他情绪障碍的主要危险因素。例如,患有季节性情感障碍(seasonal affective disorder,SAD)—一种与冬季极度缩短的日照期相关的情绪障碍,该疾病改变了暗期褪黑激素的水平并且表现出变化的昼夜节律周期。通过“生物钟学疗法(chronobiological therapy)”可以缓解SAD症状【17】。
事实上,或多或少所有成功的情绪障碍治疗似乎都会与昼夜节律的调节相关,比如节律稳定,甚至重置内部生物钟时间等,即使有时候这些对于治疗不一定是必要的,但也绝对是有帮助的。当我们生了病去医院看病时,不管大病小病,医生一定会提醒我们要好好休息,规律生活。在现代社会中,世界上80%的人口现在会在夜间暴露在光线下【18】;20%的欧洲人和29%的美国工人从事倒班制的工作,这些行为使他们更容易出现节律紊乱和疾病。
因此,生物钟对我们的健康至关重要。虽然许多研究人员最初从基础科学角度研究昼夜节律,但越来越多的研究揭示节律紊乱会导致许多疾病,并让我们不堪重负。因此,昼夜节律研究已不仅仅是生物学研究的重要领域,它也将对未来的临床研究产生重大影响。另外,已经报道的这些研究也强调了现在正是将时钟/节律分子生物学应用于人类健康的绝佳时机。
奥沙利铂(Oxaliplatin):生物钟学如何破解时间之谜
药物开发是一项复杂的科研活动,需要根据受试者确定潜在新药的推荐剂量,而不论时间、性别、年龄、生活方式或并存病症。在这方面,制药公司长期以来一直试图通过提高I期、II期和III期临床试验的成功率来改善从动物模型到人类的转化途径。然而,尽管有最佳的药代动力学/药效学(pharmacokinetics/pharmacodynamics,PK/PD)、靶特异性、组织可用性和精心的患者试验组选择,但许多药物仍然不能从临床前试验走到最后的认证【19】。即使上市后,有些药物也会因不良反应而被下架或撤市【20,21】。虽然有许多因素(例如:排卵周期长度、低LDL胆固醇或寿命)导致将药物从啮齿动物研究转化为人类应用的失败,但昼夜节律因素也可能与此类失败有关。比如夜间动物的临床前研究是否是在最合适的时间测试药物?对人类的测试是否没有考虑时间安排?或者是根本不考虑时间或节律的相关因素?
奥沙利铂是一种由于忽略生物钟效应而有可能被放弃临床应用的药物之一。奥沙利铂是目前广泛用于治疗结肠癌的铂类抗癌药,在全球范围内被广泛认可和使用。但是在1990年,法国知名制药公司Rhone-Poulenc-Rorer的I期临床试验中【22】,因为它的过量毒性被停止使用。后来,该药物被出售给刚刚建立的瑞士制药集团Debiopharm,他们想通过时间药理学建立奥沙利铂的安全性和有效性。小鼠的毒性和功效研究【23】为临床试验中需要考虑到时间因素提供了指导【24】。最终,临床I期和临床II期试验中,在考虑了昼夜节律的时间调节规律后,发现该药物在16:00时达到峰值递送效率,也确定了它的药物的安全性【25】。在随后的大型II期临床试验中,奥沙利铂提供了其在结直肠癌中临床疗效的首次证明,在这个过程中,研发人员充分考虑了“时间调节递送过程”在其中扮演的角色【26】;这一发在随机III期试验中也得到了充分证实【27】。因此,在奥沙利铂的开发与应用过程中,通过整合时间药理学,最终确定了最佳时间的药物递送,将不利影响做到了最小化同时将治疗功效做到了最大化。这个案例是唯一一个有充分记录的例子——差点由于缺乏对昼夜节律方面的考虑误导了后续开发。但先前的失败是一个突出的例子,它强调了临床前和临床研究人员应当好好考虑昼夜节律时间对于医学研究和疾病治疗的紧迫性。这些都应被考虑到新药开发的临床阶段、以及新疗法的临床试验之中。
二、节律系统:进化保守性与生理学相关性
解读果蝇生物钟分子机制的三位科学家获得了2017年诺贝尔生理学或医学奖。虽然他们主要研究对象是果蝇,但是生物钟机制在动物中非常保守【28】,只是,在哺乳动物中许多组分存在多个拷贝,这增加了该系统在哺乳动物中的复杂性和冗余性【29,30】。
PERIOD蛋白(PER)似乎在所有动物的核心生物钟中具有相同的结构和功能,尽管其响应的环境信号功能在不同的物种中不同【30】。比如,果蝇和小鼠PER蛋白存在少许差异【31】,但产生节律的基本分子机制高度相似。此外,这种生物节律的时钟机制在专门的大脑区域(例如,果蝇中的辅助髓质[AME]和哺乳动物下丘脑的视交叉上核[suprachiasmatic nucleus,SCN])中具有活性,与感光系统、激素系统具有紧密的解剖学和功能连接【32】。昆虫和哺乳动物的主时钟具有神经调节功能,并使用多种神经肽作为信号分子【33】。昆虫和哺乳动物主时钟都影响行为节律,并通过体液因子和外周自主神经系统的组合连接到外周时钟。
在哺乳动物中,SCN与外周器官之间的关系已经确立。为了调整其节律,SCN从视网膜接收信息【34】,通过自主神经支配与其他时钟通信,调节全身,如体温、激素信号和进食消化过程【35】。SCN可以通过神经肽直接影响行为和外周节律【36】,也可以通过自主神经间接支配控制外周时钟。例如,SCN通过室旁核影响肝脏中的葡萄糖稳态或肾上腺分泌糖皮质激素【37】。此外,来自心脏、肾脏、胰腺、肺和甲状腺的生物钟也受自主神经连接控制。另外,由休息和活动周期调节的进食和体温节律是调节肝脏、胰腺、心脏和肾脏的环境因素【38】。
节律基因的鉴定以及这些基因介导的细胞过程,可以很好地解释个体神经元如何自主振荡。虽然个体神经元随昼夜周期性振荡的能力现已得到很好的证实【39】,但是对于动物个体,尤其是高等动物个体来说,几乎所有的生物钟行为都是组织内部和组织之间协同自主振荡的结果。有趣的是,节律单元之间的通信会赋予该组织的新属性。例如,中央节律神经元之间的同步导致编码和存储日长的能力,这提供了关于季节的信息,这是许多生物体中生物钟的主要任务【32】。这些能力并不在单神经元水平存在。此外,哺乳动物的节律中心也受到外部环境—主要是光等的影响,并且它还可以整合来自其他脑区和外周器官的信号。这些信号都以重要的方式改变了节律中心的特性,这种信号信号不仅提供了适应性,而且提供了稳定性和精确性。
节律中心的鉴定提供了基础“构建模块”,可以让人们了解单个神经元内的分子反馈环路如何与其他神经元中的类似机制相互作用。该信息产生神经元网络,既具有基本分子振荡器的性质,也具有与其他神经元相互作用而产生的性质【32】。显然,理解分子、细胞和神经组织的多个层次生物学节律,对于将人类昼夜节律生物学的转化将是极其重要的。
三、转化医学面临的挑战
由于实际原因和工作日的安排,研究人员通常是在白天进行实验,但这种设计在使用实验室啮齿动物时会产生特殊的问题。最常见的区别是显而易见的:小鼠和大鼠都是夜间活动的动物。事实上,美国国家生物医学研究协会(National Association for Biomedical Research in the US)报告说,小鼠和大鼠占用了研究用所有实验动物的95%。小鼠和大鼠在夜间活动,并且在夜间具有高代谢率、活跃的行为和高度警觉性;但人类是昼行的,恰好相反,人类在白天才具有更高的活跃性。因此,研究过程中的主要问题是:大多数使用啮齿动物的研究人员通常在白天进行实验,而这时是相当于的小鼠的生理学夜间时期,与人类的夜间相对应,但是病人通常在夜间是不会给药的,这是当今研究面临的问题与障碍。当研究人员试图将临床前研究结果转化到人类试验时,夜间啮齿动物和人类之间的这些基本生物学差异可能构成严峻的挑战。结果,可能导致转化的失败,或者错过某些重要的成果转化。
啮齿动物的白天与人类的白天
在实验过程中,大多数行为和代谢实验表现出强烈的时间依赖性,例如学习【40】或葡萄糖耐量测试【41】,而这些变化对于实验方案的设计又是重要的考虑因素。然而,动物与人在这方便的差异至少在两个方面变得更加微妙和难以评估。
首先,多数啮齿动物是多相睡眠(polyphasic sleepers):虽然睡眠大部分时间都会在白天,但是啮齿动物也会在夜间以及没有外界干扰的时候频繁出现短暂的睡眠和觉醒【42】。昼夜节律系统和睡眠稳态是紧密相连但又是相对独立的两个驱动系统,其中昼夜节律驱动的觉醒是独特的、具有时间性的,它可以驱动稳态睡眠系统,以巩固睡眠和觉醒之间的一天24小时节奏【43】。因此,尽管睡眠在分子机制和突触行为这两个方面具有高度保守性,但“睡眠压力”的影响难以评估。此外,也许由于正常的睡眠频率,啮齿动物一般会有个4小时的强迫觉醒,这跟人类更长时间的睡眠觉醒相当。其次,啮齿动物一般会频繁地进食以维持代谢,这使得实验室中长时间的禁食变得不自然。因此,典型的食物剥夺条件代表轻度饥饿,单日禁食可导致体重下降高达20%【44】。同样,温度的变化会导致进食行为发生巨大变化。研究表明,保持在33℃的小鼠比保持在20℃的小鼠少吃50%,小鼠保持在11℃会比室温的小鼠多吃37%的食物【45】。总体而言,在相当于动物的睡眠阶段进行实验可能会对其生理学,和将其研究结果转化为人类的能力产生重大影响。
夜间与白天节律系统对比
最近,远古的哺乳动物活动模式被发现和重建。数据表明,由于在中生代早期哺乳动物(夜间活动)和恐龙(白天活动)之间的时间分隔,哺乳动物经历了一个夜间瓶颈(nocturnal bottleneck)【46】。哺乳动物的昼行活动出现在恐龙灭绝后的新生代。随着这种变化,在昼夜哺乳动物中出现了一些适应性,以优化其生理休息—活动的周期。从理论上讲,可能存在三种不同类型的适应。首先是分子钟的改变,使其由适应夜间改变为适应白天;其次,输入传感器的改变,使得它们以此前相反的方式影响分子钟机制;第三,时钟信号的解释可能是相反的,这可以使生理途径进行适当调节。
实验表明,夜行和昼行动物的代谢活动节律相似【47】。在分子水平上,节律基因的表达在两类动物中表现出相同的相位,并且都是光依赖的【48】。同样,它们对夜间感知的光的行为反应也是相似的【49】。然而,在SCN神经元、脑节律基因和外周组织中,可能的节律目标因子的节律性在夜行和昼行动物中显示相反的阶段,例如生长因子α(TGFα)【50】。此外,激素(如糖皮质激素,瘦素和生长素释放肽)和代谢物(葡萄糖和游离脂肪酸)在夜行和昼行啮齿动物中也表现出相反的循环阶段【51】。
然而,有证据表明,夜行和昼行哺乳动物的生物钟输入途径不同。例如,昼行物种树鼠(Tupaia)在恒定的黑暗条件下显示出心律失常【52】,而夜间小鼠在这些相同的条件下是正常的节律性和自由奔跑的活动。然而,在恒定的强光条件下,情况会逆转:夜间啮齿动物会变得心律失常,而昼行树鼠则表现出强劲、有节奏的自由活动状态【52】。与核心时钟阶段相似,夜行和昼行物种之间的差异可能来自细胞和神经网络水平而不是遗传水平。解剖学研究观察到,在昼行动物中,经典的光感受器在光反应中比在夜间动物中的发挥了更重要的作用【53】。光抑制和光活化细胞之间的比例在两种动物之间不同,则表明它们的光输入机制不同【54】。总的来说,适应昼夜性似乎也可能包括SCN上游的途径。
上述观察结果与最近对狒狒神经和外周组织中昼夜转录组的研究分析基本一致【50】。昼行狒狒和夜间小鼠之间的比较显示,除了SCN之外,大多数时钟基因的峰值相位在可比较的组织之间是相反的。实际上,在所有哺乳动物物种中,松果腺是不依赖于夜间或昼行活动的组织器官,仅在夜间分泌褪黑激素【55】。这种现象在外周组织是多样且自主的。研究表明,小鼠、大鼠甚至人类中的外周器官(但不是SCN)的时钟相位受喂养—禁食周期循环的支配作用,表明食物的摄取是外周器官的主要同步器【56】。胰岛素信号传导驱动时钟蛋白PER的合成,以在摄食时间内引导昼夜节律【57】。这些可以解释在夜行和昼行物种之间,存在外周振荡器受喂食时间活动影响的循环模式。然而,所有物种在SCN和外周器官之间保持着恒定相位关系。如上所述,啮齿动物SCN将光信号整合到自主分子和电子振荡中,而自发分子和电子振荡又通过神经和体液途径传递到身体。尽管糖皮质激素将SCN信号传递给外周时钟,但是反馈信号可以在没有SCN的情况下,依赖胰岛素和IGF-1【57】传送到外周时钟【58】。因此,考虑到夜间物种中SCN和外周时钟与昼行物种相比的相反相位关系,开发与人类生物钟相关的模式生物,用于疾病治疗可能是非常有用的。
生理节律药代动力学(Circadian Pharmacokinetics)
在啮齿动物睡眠期间进行的实验操作不仅会影响结果向临床应用的转化,而且由于药代动力学的变化,在一天的不同时间施用药物也会导致各种结果。药物的药代动力学受其物理化学特性和吸收、分布、代谢及排泄(absorption, distribution, metabolism, and excretion,ADME)等特性的支配。早在20世纪80年代,科学家就对药代动力学、时间药代动力学的潜在昼夜节律调节进行了综述【59】,并研究了涉及ADME不同方面因素的节律生物学调节问题。
已经利用实验啮齿动物和人类进行过试验的数百种化合物,它们的ADME特性有可能都受到昼夜变化的影响【60】。在某种程度上,它们受到昼夜休息活动模式的影响,例如进餐时间、睡眠—觉醒周期和身体活动等,所有这些都可以调节血压和血流。从影响程度来讲,不仅取决于给药途径和排泄途径,还取决于胃pH和胃肠动力的昼夜节律调节,这些都会影响药物的吸收。相比之下,血流和毛细血管灌注同样影响药物从胃肠道的吸收,分布到组织和靶器官,甚至通过肾脏中的肾小球滤过率排泄【61】。最近的研究表明,血脑屏障的异质物外排也受到昼夜节律的调节,这可能影响针对大脑的药物治疗的反应【62】。
总之,昼夜节律调节对给定药物的ADME性质(以及时间药代动力学的相关性)产生影响,在很大程度上取决于化合物在吸收、分布和吸收过程中与转运蛋白相互作用的程度,以及代谢过程。因此,给定药物的药代动力学可能根据其递送当天的时间不同而不同,这一方面尚未在临床研究、药物开发、监管机构注册或医学和药学实践中进行系统检查。应特别注意的是一些窄谱的治疗药物,或药效学效应与血浆或组织水平之间的相关性,它们都可能很大程度上受到生物钟调节【63】。并且,所有这些参数在不同的模式生物中都可能存在很大差异。
治疗结果取决于治疗时间
药物功效不仅取决于药物的药代动力学,还取决于生物钟调节基因的内部状态,这反过来将决定靶细胞的敏感性,和在一天的特定时间内对药物的吸收途径。
治疗疾病的时间药理学显示,当给药时间适当时,功效可以得到改善,副作用也会减少。例如,与下午相比,早晨流感疫苗接种的抗体水平较高【64】。接受吲哚美辛(indomethacin)缓释剂治疗髋关节或膝关节骨性关节炎的患者,在早晨给药后意外发生率升高33%,而晚上给药则为7%。在主要是夜间疼痛或早晨疼痛的受试者中,晚上给药的止痛和抗炎作用最有效【65】。在哮喘儿童中,晚上服用茶碱缓释剂可以达到最大的给药功效【66】。在肿瘤学中,奥沙利铂(oxaliplatin)、5-氟尿嘧啶(5-fluorouracil)和亚叶酸钙(leucovorin)药物经常联合用于治疗转移性结直肠癌,当遵循药物的时间调节后,在以恒定的速度持续5天实验中,仅在14%的患者中产生严重的粘膜毒性,与接受“标准”输注的患者为76%的比例相比显著降低【27】。一项涉及842例转移性结直肠癌患者的三项国际随机试验的分析进一步证明,三药物的“时间疗法”计划显着提高了男性(而不是女性)的总体生存率【67】。这些结果引发了进一步的临床前和临床研究,旨在提供可靠和实时的昼夜节律计时度量系统,以个性化时间治疗策略。根据患者的自身条件,这种昼夜节律生物标志物评估显然是定制时间疗法的必要条件。此外,在对1,077名癌症患者进行的汇总分析中,与可靠性相比,昼夜节律中断的病例与生存率和生活质量的降低相关,这一发现支持了为患者开发时钟生物学靶向疗法的需求【61】。
几项大型研究强调了治疗的昼夜节律时间与过敏、风湿病、睡眠、心血管和恶性疾病的临床耐受性和/或疗效的相关性(表1)。值得注意的是,大多数药物在晚上给药时显示出更大的功效。相反,糖皮质激素显示出相反的效果,在早晨具有更大的功效。例如,将类风湿性关节炎的标准泼尼松(prednisone)治疗与晚上摄入慢性替尼龙片进行比较,该片剂在清晨自动释放药物,遵循时间节律释放片剂使中位关节僵硬度缓解率提高22%,而标准泼尼松治疗则为0.4%【68】。值得注意的是,大多数靶向昼夜节律相关基因的畅销药物,半衰期短于6小时。因此,给药时间对半衰期短的药物至关重要【69】。短半衰期化合物的一个例子是阿司匹林,其靶向生物钟调控的基因(如:PTGS1,也叫 COX1),并且在夜间以低剂量递送方式调节血压【70】。因此,时间药理学和昼夜节律生物标志物研究现在正在塑造精确和个性化医学时代的慢性病时间疗法【61】。

表1. 药物在早晨与晚上疗程中的功效
四、提高药物试验临床结果的潜在解决方案
a.对临床前研究的时间和模型的考虑
如上所述,将基础研究结果转化为临床的关键难点来自对啮齿动物进行的临床前研究。通过颠倒啮齿动物的明暗周期可以很容易地纠正啮齿动物和人类之间的生物钟不匹配问题,从而消除科学家在夜间进行实验的必要性。那么另外的解决方案是将昼行啮齿动物纳入临床前药物测试吗?也不一定。这种设计即使在一天的不同时间测试药物,也很难测试得到它们各自的最佳疗效和减少毒性的时机,因为这些结果不仅取决于药物代谢和目标的节律性,而且还取决于模式生物中药剂反应的读数。
或许疾病模型才是测试药物的最强有力的论据,而不是它的昼夜性。不过,也有一些昼行啮齿动物的数量(例如,蒙古沙鼠[Meriones unguiculatus],智利八齿鼠 [Octodon degus],非洲尼罗河草鼠[Arvicanthis niloticus]和羚羊地松鼠[Ammospermophilus leucurus])可供选择,它们作为药物开发的实验模型的价值值得探索【71】。更简单和自然的方法是在正常啮齿动物(小鼠和大鼠)的住房环境中逆转或改变光暗循环,以便在白天进行实验工作而没有与相位相关的影响。例如,从10:00到20:00关灯,仅允许动物看护人在早晨光照下完成饲养任务,而其它动物实验在黑暗中进行【72】。许多测试表明夜行动物的夜间行为和认知能力更强【73】。啮齿类动物的强直性疼痛敏感性在白天最大【74】。还可以使用具有独立光暗循环的隔离式外壳,或自动化动物时间生物学设施,其中的光暗时间可以通过计算机编程【75】。在这样的动物设施中,应避免意外的光污染(例如来自走廊)或可能带来动物节奏的噪音。另一种解决方案是在没有人为干预的情况下使用自动化系统在夜间收集数据,其中夜视镜或相机可以提供在黑暗中进行实验的手段。
b.通过靶标生物钟系统改善治疗效果
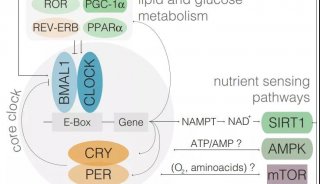
在控制动物的昼夜周期并考虑临床前药物治疗的时间时,另一种改善治疗效果的方法是针对节律系统。分析表明,许多生物钟调节基因与疾病基因高度相关【69】。许多(但不是全部)节律调节基因在阿尔茨海默病、精神分裂症和唐氏综合症等疾病中发生突变,并参与神经衰变。其他节律相关疾病包括肥胖症、2型糖尿病和癌症等。衰老导致生物节律基因的转录组重编程,使其在器官中受到差异调节【76】。鉴于生物钟调节大多数人体生理学【77】,其中大约一半的人类蛋白质编码基因受生物钟调节(包括药物转运蛋白,代谢酶和靶标)【78】。因此,直接靶标生物钟调节基因对于疾病的治疗或许更让人感兴趣。
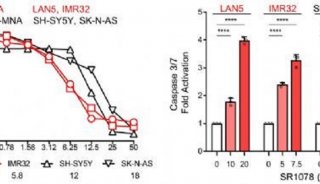
抑制或增强目标生物钟系统。鉴于基本的昼夜节律机制是转录/翻译激活和抑制的反馈环,对生物钟功能的任何抑制基本上阻止了朝向一个极端或另一个极端的机制。另一方面,增强昼夜节律可能为包括癌症在内的治疗提供优雅的“无伤害”机制【79】。例如,在一项研究中,扰乱的生物钟功能导致从非酒精性脂肪肝病(NAFLD)向纤维化和癌症的进展【80】。这种变化通过节律基因的遗传破坏得到了加强。再比如,通过增强BMAL1/CLOCK或抑制REV-ERBα活性来改善节律功能可以改善结果。据报道,与早晨相比,下午接受心脏手术的患者的主要心脏不良事件发生率较低。与早晨人类心肌中REV-ERBα的高表达一致,在小鼠睡眠—觉醒过渡时使用选择性拮抗剂(SR8278)阻断REV-ERBα的功能,可保护小鼠免受心肌损伤【6】。
利用昼夜节律。随着临床前研究人员对生物钟调节生理机制的新发现,这些机制中的每一种都为治疗提供了潜在的干预点。我们也可以举出很多例子说明生物钟基因参与疾病的调节。例如,生物钟蛋白以许多不同方式相互作用以控制药物代谢和运输。GLUT2是一种溶质载体和药物转运蛋白,在小鼠和人体中具有高振幅的时钟调节作用。在疾病治疗过程中,在合适的时间添加链脲霉素、化学治疗剂和GLUT2底物可显著降低其毒性。在夜间用CCR2拮抗剂RS102895治疗动脉粥样硬化可减少病变的形成,而白天治疗无效【5】。数百种其他药物代谢酶、转运蛋白和药物靶标也是时钟调节的,许多具有高振幅调节功能。这些知识可用于改善现有药物的作用,但也纳入新候选药物的试验中。
不依赖于生物钟系统的基因表达调节。最后,另一种可能性是开发靶向时钟蛋白的治疗药物,而不管它们的生物钟功能如何。实际上,全面的ChIP-seq研究表明CRY1和CRY2等单个节律蛋白可能与其他节律蛋白无关,而是与非昼夜节律性启动子相关【81】,并且,可能影响这些节律蛋白的药物能以不依赖于时钟系统的方式影响着这些基因的转录产生。因此,时钟蛋白靶向药物也可以发挥与疾病相关、但不依赖于生物钟节律的转录效应。
理解生物钟节律的重要性
条件诱变已经阐明了个体组织生物钟在整个睡眠—觉醒周期的不同时间对体内平衡的贡献。当控制一天中的时间、营养状态(例如,禁食或喂养)和发育年龄时,不同器官的局部节律将合成代谢和分解代谢过程分配到一天中的不同时间【82】。有些领域我们仍然了解不多,比如特化的起搏器节律神经元和星形胶质细胞,它们是如何在能量平衡、睡眠、情绪、学习和记忆中涉及的通路中的保持联系和稳定的。由于生物钟是稳健且相互关联的,因此其中的挑战是:动物中个体因素的扰动可能导致另一分支的补偿性上调,遗传策略必须控制这种代偿性基因调控环带来的影响。例如,在实验设计中,研究人员可能会考虑在自由运行条件下监测行为和生理终点,或使用基于细胞的模型,包括来自不同组织的三维器官【83】,这些组织缺乏复杂的调节网络,但是临床前的应用必须将个体实验推进到底。推进完整昼夜节律的概念及其在哺乳动物生物体中的作用,仍然是绘制生物钟在人类健康中作用的关键目标。
五、结论
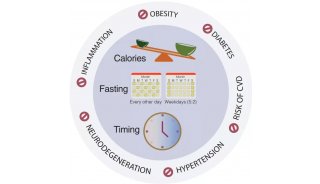
有明确证据表明昼夜节律机制参与调节了众多的疾病,但研究人员对其在临床前和临床研究中的重要性的认识却很少。本文重点介绍了夜间啮齿动物在睡眠时间进行实验时遇到的障碍,以及这种实验设计如何影响到向人类的转化。我们提倡使用生物节律知识进行临床前研究的范式转换,以便通过考虑药物动力学、目标和疾病的昼夜节律状态来适当地制定治疗干预措施(图1)。考虑一天中的生物钟疗法可以显著改善临床试验成功率。在试验或者临床中,睡眠—觉醒周期必须在治疗方案中得到充分考虑。另外一种新方法是开发和利用针对时钟系统的药物。

图1. 对精密和个性化医学使用时间药理学
最后,为了加速这个领域的发展,资助机构需要更大的投入。与此同时,制药和生物技术公司应将现有的昼夜节律知识应用于其药物开发渠道。甚至学校开设相关课程,对相关生物学知识的传播也会起到很大的作用,使该领域有源源不断的生力军。总之,是时候认真对待“时间”了(It is time to take time seriously)!
原文链接:
https://doi.org/10.1016/j.cmet.2019.06.019
参考文献
1. Bass, J. & Lazar, M. A. Circadian time signatures of fitness and disease. Science 354, 994-999 (2016).
2. Thosar, S. S., Butler, M. P. & Shea, S. A. Role of the circadian system in cardiovascular disease. The Journal of clinical investigation 128, 2157-2167 (2018).
3. Haus, E. Chronobiology of hemostasis and inferences for the chronotherapy of coagulation disorders and thrombosis prevention. Advanced drug delivery reviews 59, 966-984 (2007).
4. Portaluppi, F. & Hermida, R. C. Circadian rhythms in cardiac arrhythmias and opportunities for their chronotherapy. Advanced drug delivery reviews 59, 940-951 (2007).
5. Winter, C. et al. Chrono-pharmacological targeting of the CCL2-CCR2 axis ameliorates atherosclerosis. Cell metabolism 28, 175-182. e175 (2018).
6. Montaigne, D. et al. Daytime variation of perioperative myocardial injury in cardiac surgery and its prevention by Rev-Erbα antagonism: a single-centre propensity-matched cohort study and a randomised study. The Lancet 391, 59-69 (2018).
7. Durgan, D. J. et al. ischemia/reperfusion tolerance is time-of-day-dependent: mediation by the cardiomyocyte circadian clock. Circulation research 106, 546 (2010).
8. Chinoy, E. D., Duffy, J. F. & Czeisler, C. A. Unrestricted evening use of light‐emitting tablet computers delays self‐selected bedtime and disrupts circadian timing and alertness. Physiological reports 6, e13692 (2018).
9. Musiek, E. S. & Holtzman, D. M. Mechanisms linking circadian clocks, sleep, and neurodegeneration. Science 354, 1004-1008 (2016).
10. Burioka, N. et al. Asthma: chronopharmacotherapy and the molecular clock. Advanced drug delivery reviews 62, 946-955 (2010).
11. Campbell, P. J., Bolli, G. B., Cryer, P. E. & Gerich, J. E. Pathogenesis of the dawn phenomenon in patients with insulin-dependent diabetes mellitus: accelerated glucose production and impaired glucose utilization due to nocturnal surges in growth hormone secretion. New England Journal of Medicine 312, 1473-1479 (1985).
12. Chellappa, S. L., Morris, C. J. & Scheer, F. A. Daily circadian misalignment impairs human cognitive performance task-dependently. Scientific reports 8, 3041 (2018).
13. Kwapis, J. L. et al. Epigenetic regulation of the circadian gene Per1 contributes to age-related changes in hippocampal memory. Nature communications 9, 3323 (2018).
14. McClung, C. A. How might circadian rhythms control mood? Let me count the ways. Biological psychiatry 74, 242-249 (2013).
15. Buxton, O. M. et al. Adverse metabolic consequences in humans of prolonged sleep restriction combined with circadian disruption. Science translational medicine 4, 129ra143-129ra143 (2012).
16. Gresham, S., Agnew, H., jr & Williams, R. L. The sleep of depressed patients: An EEG and eye movement study. Archives of General Psychiatry 13, 503-507 (1965).
17. Lewy, A. J., Lefler, B. J., Emens, J. S. & Bauer, V. K. The circadian basis of winter depression. Proceedings of the National Academy of Sciences 103, 7414-7419 (2006).
18. Falchi, F. et al. The new world atlas of artificial night sky brightness. Science advances 2, e1600377 (2016).
19. Cook, D. et al. Lessons learned from the fate of AstraZeneca's drug pipeline: a five-dimensional framework. Nature reviews Drug discovery 13, 419 (2014).
20. Wang, X., Armstrong, M., Cairns, B., Key, T. & Travis, R. Shift work and chronic disease: the epidemiological evidence. Occupational medicine 61, 78-89 (2011).
21. Zhang, W., Roederer, M. W., Chen, W.-Q., Fan, L. & Zhou, H.-H. Pharmacogenetics of drugs withdrawn from the market. Pharmacogenomics 13, 223-231 (2012).
22. Extra, J. M. et al. Phase I study of oxaliplatin in patients with advanced cancer. Cancer chemotherapy and pharmacology 25, 299-303 (1990).
23. Granda, T. et al. Circadian optimisation of irinotecan and oxaliplatin efficacy in mice with Glasgow osteosarcoma. British journal of cancer 86, 999 (2002).
24. Levi, F. Circadian chronotherapy for human cancers. The lancet oncology 2, 307-315 (2001).
25. Caussanel, J.-P. et al. Phase I trial of 5-day continuous venous infusion of oxaliplatin at circadian rhythm-modulated rate compared with constant rate. JNCI: Journal of the National Cancer Institute 82, 1046-1050 (1990).
26. Lévi, F. et al. A chronopharmacologic phase II clinical trial with 5‐fluorouracil, folinic acid, and oxaliplatin using an ambulatory multichannel programmable pump. High antitumor effectiveness against metastatic colorectal cancer. Cancer 69, 893-900 (1992).
27. Levi, F., Zidani, R. & Misset, J.-L. Randomised multicentre trial of chronotherapy with oxaliplatin, fluorouracil, and folinic acid in metastatic colorectal cancer. The Lancet 350, 681-686 (1997).
28. Takahashi, J. S. Transcriptional architecture of the mammalian circadian clock. Nature Reviews Genetics 18, 164 (2017).
29. Clayton, J. D., Kyriacou, C. P. & Reppert, S. M. Keeping time with the human genome. Nature 409, 829 (2001).
30. Partch, C. L., Green, C. B. & Takahashi, J. S. Molecular architecture of the mammalian circadian clock. Trends in cell biology 24, 90-99 (2014).
31. Shafer, O. T., Rosbash, M. & Truman, J. W. Sequential nuclear accumulation of the clock proteins period and timeless in the pacemaker neurons of Drosophila melanogaster. Journal of Neuroscience 22, 5946-5954 (2002).
32. Helfrich-Förster, C. Does the morning and evening oscillator model fit better for flies or mice? Journal of biological rhythms 24, 259-270 (2009).
33. Yoshii, T. et al. The neuropeptide pigment-dispersing factor adjusts period and phase of Drosophila's clock. Journal of Neuroscience 29, 2597-2610 (2009).
34Hannibal, J. & Fahrenkrug, J. Melanopsin: a novel photopigment involved in the photoentrainment of the brain's biological clock? Annals of medicine 34, 401-407 (2002).
35. Mohawk, J. A., Green, C. B. & Takahashi, J. S. Central and peripheral circadian clocks in mammals. Annual review of neuroscience 35, 445-462 (2012).
36. Cheng, M. Y. et al. Prokineticin 2 transmits the behavioural circadian rhythm of the suprachiasmatic nucleus. Nature 417, 405 (2002).
37Ishida, A. et al. Light activates the adrenal gland: timing of gene expression and glucocorticoid release. Cell metabolism 2, 297-307 (2005).
38. Buhr, E. D., Yoo, S.-H. & Takahashi, J. S. Temperature as a universal resetting cue for mammalian circadian oscillators. Science 330, 379-385 (2010).
39. Herzog, E. D., Takahashi, J. S. & Block, G. D. Clock controls circadian period in isolated suprachiasmatic nucleus neurons. Nature neuroscience 1, 708 (1998).
40. Chaudhury, D. & Colwell, C. S. Circadian modulation of learning and memory in fear-conditioned mice. Behavioural brain research 133, 95-108 (2002).
41. la Fleur, S. E., Kalsbeek, A., Wortel, J., Fekkes, M. L. & Buijs, R. M. A daily rhythm in glucose tolerance: a role for the suprachiasmatic nucleus. Diabetes 50, 1237-1243 (2001).
42. Simasko, S. M. & Mukherjee, S. Novel analysis of sleep patterns in rats separates periods of vigilance cycling from long-duration wake events. Behavioural brain research 196, 228-236 (2009).
43. Dijk, D.-J. & Czeisler, C. A. Paradoxical timing of the circadian rhythm of sleep propensity serves to consolidate sleep and wakefulness in humans. Neuroscience letters 166, 63-68 (1994).
44. Dohm, G. L., Tapscott, E. B., Barakat, H. A. & Kasperek, G. J. Influence of fasting on glycogen depletion in rats during exercise. J Appl Physiol Respir Environ Exerc Physiol 55, 830-833, doi:10.1152/jappl.1983.55.3.830 (1983).
45. Bronson, F. H. Susceptibility of the fat reserves of mice to natural challenges. J Comp Physiol B 157, 551-554 (1987).
46. Maor, R., Dayan, T., Ferguson-Gow, H. & Jones, K. E. Temporal niche expansion in mammals from a nocturnal ancestor after dinosaur extinction. Nat Ecol Evol 1, 1889-1895, doi:10.1038/s41559-017-0366-5 (2017).
47. Schwartz, W. J., Reppert, S. M., Eagan, S. M. & Moore-Ede, M. C. In vivo metabolic activity of the suprachiasmatic nuclei: a comparative study. Brain Res 274, 184-187, doi:10.1016/0006-8993(83)90538-3 (1983).
48. Mrosovsky, N., Edelstein, K., Hastings, M. & Maywood, E. Cycle of period gene expression in a diurnal mammal (Spermophilus tridecemlineatus): implications for nonphotic phase shifting. Journal of Biological Rhythms 16, 471-478 (2001).
49. Mahoney, M., Bult, A. & Smale, L. Phase response curve and light-induced fos expression in the suprachiasmatic nucleus and adjacent hypothalamus of Arvicanthis niloticus. Journal of biological rhythms 16, 149-162 (2001).
50. Mure, L. S. et al. Diurnal transcriptome atlas of a primate across major neural and peripheral tissues. Science 359, eaao0318 (2018).
51. Jha, P. K., Challet, E. & Kalsbeek, A. Circadian rhythms in glucose and lipid metabolism in nocturnal and diurnal mammals. Molecular and cellular endocrinology 418, 74-88 (2015).
52. Meijer, J., Daan, S., Overkamp, G. & Hermann, P. The two-oscillator circadian system of tree shrews (Tupaia belangeri) and its response to light and dark pulses. Journal of biological rhythms 5, 1-16 (1990).
53. van Diepen, H. C., Ramkisoensing, A., Peirson, S. N., Foster, R. G. & Meijer, J. H. Irradiance encoding in the suprachiasmatic nuclei by rod and cone photoreceptors. The FASEB Journal 27, 4204-4212 (2013).
54. Meijer, J. H., Rusak, B. & Harrington, M. E. Photically responsive neurons in the hypothalamus of a diurnal ground squirrel. Brain research 501, 315-323 (1989).
55. Pévet, P. Melatonin in animal models. Dialogues in clinical neuroscience 5, 343 (2003).
56. Stokkan, K.-A., Yamazaki, S., Tei, H., Sakaki, Y. & Menaker, M. Entrainment of the circadian clock in the liver by feeding. Science 291, 490-493 (2001).
57. Crosby, P. et al. Insulin/IGF-1 Drives PERIOD Synthesis to Entrain Circadian Rhythms with Feeding Time. Cell 177, 896-909. e820 (2019).
58. Damiola, F. et al. Restricted feeding uncouples circadian oscillators in peripheral tissues from the central pacemaker in the suprachiasmatic nucleus.Genes & development 14, 2950-2961 (2000).
59. Reinberg, A. & Smolensky, M. Circadian changes of drug disposition in man. Clinical pharmacokinetics 7, 401-420 (1982).
60. Lévi, F. & Schibler, U. Circadian rhythms: mechanisms and therapeutic implications. Annu. Rev. Pharmacol. Toxicol. 47, 593-628 (2007).
61. Ballesta, A., Innominato, P. F., Dallmann, R., Rand, D. A. & Levi, F. A. Systems chronotherapeutics. Pharmacological reviews 69, 161-199 (2017).
62. Zhang, S. L., Yue, Z., Arnold, D. M., Artiushin, G. & Sehgal, A. A circadian clock in the blood-brain barrier regulates xenobiotic efflux. Cell 173, 130-139. e110 (2018).
63. Bruguerolle, B. & Lemmer, B. Recent advances in chronopharmacokinetics: methodological problems. Life sciences 52, 1809-1824 (1993).
64. Long, J. E. et al. Morning vaccination enhances antibody response over afternoon vaccination: A cluster-randomised trial. Vaccine 34, 2679-2685 (2016).
65. Levi, F., Louarn, C. L. & Reinberg, A. Timing optimizes sustained‐release indomethacin treatment of osteoarthritis. Clinical Pharmacology & Therapeutics 37, 77-84 (1985).
66. Smolensky, M. et al. Administration-time-dependency of the pharmacokinetic behavior and therapeutic effect of a once-a-day theophylline in asthmatic children. Chronobiology international 4, 435-447 (1987).
67. Giacchetti, S. et al. Sex moderates circadian chemotherapy effects on survival of patients with metastatic colorectal cancer: a meta-analysis. Annals of oncology 23, 3110-3116 (2012).
68. Buttgereit, F. et al. Efficacy of modified-release versus standard prednisone to reduce duration of morning stiffness of the joints in rheumatoid arthritis (CAPRA-1): a double-blind, randomised controlled trial. The Lancet 371, 205-214 (2008).
69. Zhang, R., Lahens, N. F., Ballance, H. I., Hughes, M. E. & Hogenesch, J. B. A circadian gene expression atlas in mammals: implications for biology and medicine. Proceedings of the National Academy of Sciences 111, 16219-16224 (2014).
70. Hermida, R. n. C. et al. Differing administration time-dependent effects of aspirin on blood pressure in dipper and non-dipper hypertensives. Hypertension 46, 1060-1068 (2005).
71. Refinetti, R. & Kenagy, G. Diurnally active rodents for laboratory research. Laboratory animals 52, 577-587 (2018).
72. Hawkins, P. & Golledge, H. D. The 9 to 5 Rodent− Time for Change? Scientific and animal welfare implications of circadian and light effects on laboratory mice and rats. Journal of neuroscience methods 300, 20-25 (2018).
73. Roedel, A., Storch, C., Holsboer, F. & Ohl, F. Effects of light or dark phase testing on behavioural and cognitive performance in DBA mice. Laboratory animals 40, 371-381 (2006).
74. Perissin, L., Facchin, P. & Porro, C. A. Diurnal variations in tonic pain reactions in mice. Life sciences 67, 1477-1488 (2000).
75. Tampellini, M. et al. Docetaxel chronopharmacology in mice. Cancer research 58, 3896-3904 (1998).
76. Sato, S. et al. Circadian reprogramming in the liver identifies metabolic pathways of aging. Cell 170, 664-677. e611 (2017).
77. Skarke, C. et al. A pilot characterization of the human chronobiome. Scientific reports 7, 17141 (2017).
78. Ruben, M. D. et al. A database of tissue-specific rhythmically expressed human genes has potential applications in circadian medicine. Science translational medicine 10, eaat8806 (2018).
79. Kiessling, S. et al. Enhancing circadian clock function in cancer cells inhibits tumor growth. BMC biology 15, 13 (2017).
80. Kettner, N. M. et al. Circadian homeostasis of liver metabolism suppresses hepatocarcinogenesis. Cancer cell 30, 909-924 (2016).
81. Koike, N. et al. Transcriptional architecture and chromatin landscape of the core circadian clock in mammals. Science 338, 349-354 (2012).
82. Peek, C. B. et al. Circadian clock NAD+ cycle drives mitochondrial oxidative metabolism in mice. Science 342, 1243417 (2013).
83. Yamajuku, D. et al. Real-time monitoring in three-dimensional hepatocytes reveals that insulin acts as a synchronizer for liver clock. Scientific reports 2, 439 (2012).