小鼠中的黄金矿脉-RenMabTM小鼠(二)
RenMabTM小鼠的免疫系统发育
人源化抗体鼠的主要用途是用在新药研发上的全人源抗体发现,如果RenMabTM鼠的免疫系统发育缺陷,不能正常地产生抗体,或者是不能以正常的方式产生抗体(比如AlivaMab鼠),那就失去了其存在的意义。
RenMabTM鼠目前来看是个六能鼠,能吃、能喝、能拉、能睡、能生和能产生抗体,在小鼠的日常维护中不需要特殊条件/照顾,从侧面证明了RenMabTM鼠发育正常。
从科学数据上来看呢?
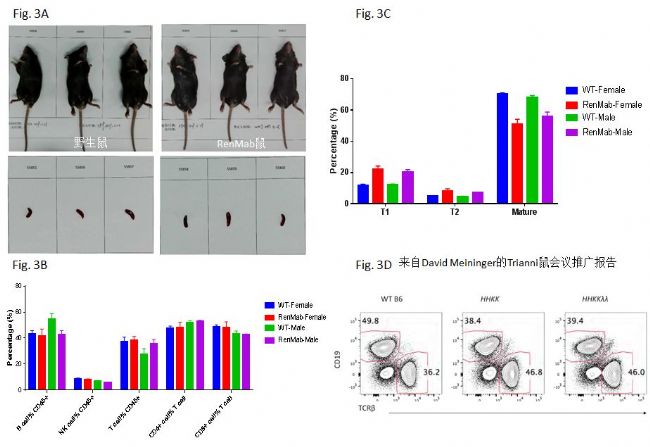
首先从外观上(Fig. 3A),RenMabTM鼠体重(上)以及脾脏形态大小(下)无显著性差异(n=3)。其它器官比如心脏、胸腺、肝脏、肺脏和肾脏等也无显著性差异(数据未显示)。这说明RenMabTM鼠和野生鼠在器官发育上完全一致。小鼠B细胞在骨髓中发育成熟,然后离开进入循环系统,定居于脾脏和淋巴结。下面以脾脏中的免疫细胞的类型、脾脏中T1,T2和成熟B细胞的比例等来判断RenMabTM鼠的B细胞发育情况。从Fig. 3B来看,无论是在RenMabTM雌鼠中还是雄鼠中,在CD45+的细胞群体中,B细胞,NK细胞和T细胞的比例基本相同(n=3)。在T细胞中,CD4+的T细胞 和CD8+的T细胞的比例,RenMabTM鼠和野生鼠没发现显著性差异。
进一步分析脾脏中B细胞发育的各个阶段,在RenMabTM鼠中,无论是雄鼠还是雌鼠,T1 B细胞(B220+IgM+IgD-)和T2 B细胞(B220+IgM+IgD+)的比例相对于野生鼠都有不同程度的升高,与此同时,成熟B细胞(B220+IgMlowIgD+)在B220+细胞中的比例也有相应下降(Fig. 3C)。这说明在脾脏中B细胞的发育过程中存在T1/T2到成熟B细胞的阻滞。这个现象一点都不惊讶,已有文献证明当参与B细胞受体信号传导的遗传因素缺失时,会导致脾脏中T1/T2到成熟B细胞的发育阻滞(Loder F., wt al, 1999 J. Exp. Med.)。RenMabTM鼠抗体V区的原位替换可能导致了某些遗传因素的缺失并且这个缺失不能被人相应位置的遗传因素所补偿,最终导致了T1/T2到成熟B细胞的发育阻滞。这种B细胞发育中的阻滞现象不会影响抗体生成,因为类似的现象在其它人源化抗体鼠比如Trianni鼠、再生元的VelocImmune鼠、OmniRat鼠、AlivaMab鼠和KyMab鼠中也存在(Fig.
3D)(McDonald L.E. et al, 2014
PNAS; Murphy A.J. et al, 2014 PNAS;Lee E.C., 2014 Nat. Biotechol;Joyce
C. et al, 2019 BioRxiv; Asensio M. et al, 2019, mAbs; Meining D. et al,
Trianni conference presentation)。在Fig. 3D中,外周血中CD19+细胞的比例在野生鼠中是49.8%,但在Trianni kappa轻链鼠中的比例只有38.4%,这也是T1/T2到成熟B细胞的发育阻滞的结果。尤其令人感兴趣的是,RenMabTM鼠和Trianni鼠都选用了类似的原位替换策略,这说明导致人源化抗体鼠T1/T2到成熟B细胞的发育阻滞的遗传因素就在被替换的鼠抗体V区中,并且很可能由于种属差别,人的参与B细胞受体信号传导的遗传因素的插入并不能提供相应的代偿。另外一种可能是小鼠中参与B细胞受体信号传导的遗传因素仍然存在,但是由于人/鼠嵌合BCR和小鼠野生BCR信号传导机制的细微差别(Mestas J. et al, 2004 J. Immunol.),导致了表达某些人BCR的鼠B细胞发育阻滞。从公众数据库中现有的人源化抗体鼠的多变区基因使用频率来看,后一种可能性不大。
正如前面提到的,在各抗体人源化鼠中观察到的B细胞发育阻滞并不影响人源化抗体鼠中抗体多样性的生成以及所产生抗体的成药性,免疫治疗中很火的O药就是一个例子。所以说,我们看到的B细胞发育阻滞现象会是一个很好的科学研究方向,但对于人源化抗体鼠做为抗体发现的工具来说却是无伤大雅的。那有同学会问,既然RenMabTM鼠存在轻微的B细胞发育阻滞现象,那我怎么知道RenMabTM鼠中抗体多样性生成中V(D)J重排机制没有受到影响呢?
RenMabTM鼠的抗体V(D)J重组机制和人的原生调控序列兼容吗?
抗体多样性生成中重链的V(D)J重排和轻链的V-J重排发生在骨髓中,B细胞发育的Pro-B和Pre-B阶段,那让我们把目光从脾脏拉回到骨髓中的抗体多样性生成。回答上面两位同学的问题,一是RenMabTM鼠的抗体V(D)J重组机制和人的原生调控序列兼容吗?二是B细胞发育的阻滞会不会造成RenMabTM鼠中抗体多样性生成中V(D)J重排机制的异常?回答这两个问题最好的办法是用二代测序的方法去解读未经免疫的RenMabTM鼠中的抗体多变区基因使用频率。大家都知道编码重链可变区的胚系基因分为三个基因家族:VH,DH和JH。其中VH有44种,DH有28种,JH有6种。当发生V(D)J重排的时候,B细胞分别选用一个VH、DH和JH基因片段组成重链CDR3,所以,重链V(D)J重排至少有44*28*6种可能,再加上重轻链配对的可能、V-D和D-J结合区的突变以及抗体亲和力成熟过程中的体细胞高频突变,这共同形成了抗体生成中的多样性。
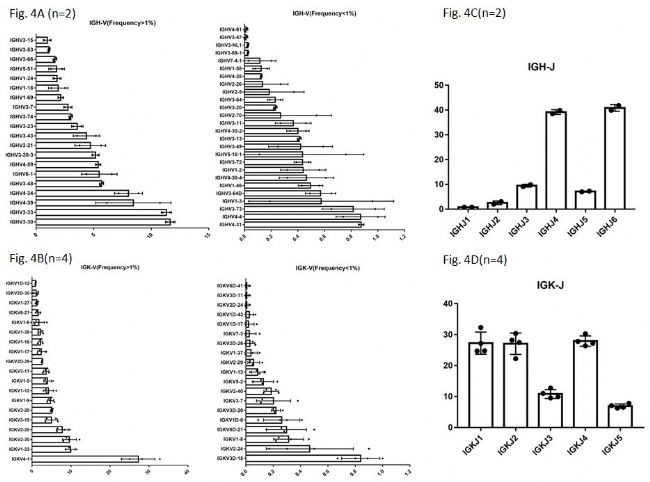
从Fig. 4A中可以看到,从两只RenMabTM鼠中,发现了46种不同的VH基因(包括两种VH假基因)。VH假基因在人外周血PBMC的免疫组库中经常被检测到,其在抗体多样性生成中的具体用途与意义不明。在RenMabTM鼠的构建中,是用人的全区段V区原位替换了鼠源的V区,两种VH假基因的发现,从另一个侧面也说明了被构建到RenMabTM鼠中的人全区段V区能够正常被鼠的V(D)J重排机制所使用。在人外周血PBMC中,通常情况下健康人的免疫组库中~70%的VH是VH3和VH4。从Fig. 4A中可以看到,RenMabTM鼠中VH3和VH4基因家族的使用频率和人外周血中是非常类似的。同样的,在两只鼠中我们观测到至少25种不同的DH基因,在四只鼠中检测到38种不同的VK基因(Fig.
4B)。所有的人JH和JK基因家族都被观测到(Fig. 4C, Fig. 4D),并且人JH/JK基因在RenMabTM鼠中的使用频率与人外周血PBMC中的使用频率非常类似。请小伙伴们注意的是,图4中V基因使用频率的数据的误差棒比较大一些,这是由于RenMabTM鼠个体之间的差异造成的。类似的个体间的差异在人体中也被经常观测到。从抗体发现的角度,这种个体之间的差异是个有利因素,因为不同的RenMabTM鼠可能会利用不同的V(D)J重排组合,从而增加了抗体生成的多样性。
有同学会问,你VK基因使用频率中,VK4-1稍微有点高呀?这个现象在再生元的Veloci鼠中也存在(感兴趣的自己去读再生元的ZL)。在野生鼠中,科学家发现重链V(D)J重排或者是轻链V-J重排的时候,野生小鼠的V(D)J重排机制会优先选用最近的VH或者是VK(Brennecke A. et al, 2018 Front. Immunol.)。而在RenMabTM鼠中,人VK4-1恰恰是离JK基因最近的。这从一个方面说明,在小鼠V(D)J重排中近水楼台先得月的机制是存在于被替换V区之外的。在小鼠的免疫应答中,具有长LCDR1的轻链基因比如mIGKV1-110或者mIGKV1-117经常被优先使用,做过鼠抗人源化的小伙伴们估计深有体会,通常的策略基于人鼠抗体结构同源模拟是使用人VK2基因家族比如VK2-28或者是VK2-30做人源化,因为VK2轻链抗体可以容纳长鼠源的LCDR1,实际上这是个很坏的选择,要想知道这种情况下什么轻链基因最好?
为什么突然谈到这一点?有心的小伙伴请去读基因泰克最近十年的ZL。
有同学说,这数据只说明了RenMabTM鼠中存在所放进去的V区基因呀,你怎么证明重链确实发生了V(D)J重排并且轻链发生了V-J重排呢?为回答这个问题,请看下面的数据。
Fig. 5A是对未经免疫的RenMabTM鼠中抗体重链的CDR3长度分布做了统计。众所周知的是,野生型小鼠的抗体重链CDR3长度分布的峰值在11-12氨基酸,而人外周血PBMC中抗体重链CDR3长度分布的中位值在14.2左右。Fig. 5A说明RenMabTM鼠中抗体重链的CDR3长度分布和人外周血PBMC中是非常类似的。更进一步看RenMabTM鼠中抗体重链的CDR3氨基酸组成分析,我们选用了一组14氨基酸长度的抗体重链基因进行分析。从Fig. 5B可以看出,RenMabTM鼠中抗体重链的CDR3氨基酸组成和人外周血PBMC中是高度相似的。主要讲以下几点:
(1)首先,在IMGT107位置,已经有很多研究证明在人外周血PBMC中此位置氨基酸使用偏向于天冬氨酸D、谷氨酸E和甘氨酸G。从图中我们可以看到,天冬氨酸D、谷氨酸E和甘氨酸G在此位置的使用总频率已经达到60%左右。
(2)其次,最近多个对人外周血PBMC中免疫组库二代测序的分析表明,随着重链CDR3长度增加,使用JH6的频率也增加,这是因为JH6是人JH基因家族中最长的。JH6中富含酪氨酸Y,所以,造成的结果就是随着重链CDR3长度增加,酪氨酸Y的使用频率也增加。Fig.
5B底部柱状热图的紫色部分是酪氨酸Y,大家可以自行做个判断,RenMabTM鼠在此特征上是不是与人高度一致。
(3)野生鼠重链CDR3中是不存在二硫键的,因为野生小鼠的DH基因不含有半胱氨酸的。在人、牛、鲨鱼等物种中,二硫键的形成是重链CDR3多样性形成的一个重要机制。在鼠中,这种机制是不存在的。在RenMabTM鼠中,因为人源DH2基因家族的引入,在重链CDR3氨基酸组成中出现了半胱氨酸C。半胱氨酸C通常是以成对的形式出现,比如CXXC或者CXXXXC。
(4)如果对野生小鼠的重链CDR3氨基酸组成做个总分析,你会发现野生小鼠的重链CDR3氨基酸组成中甘氨酸G和丝氨酸S的比例很高,那是因为野生小鼠DH基因中富含甘氨酸G和丝氨酸S。在人外周血PBMC的重链CDR3氨基酸组成中,甘氨酸G、天冬氨酸D和酪氨酸Y的使用频率相对较高,在此背景下,请小伙伴们看氨基酸组成热图自行判断RenMabTM鼠生成抗体的质量。
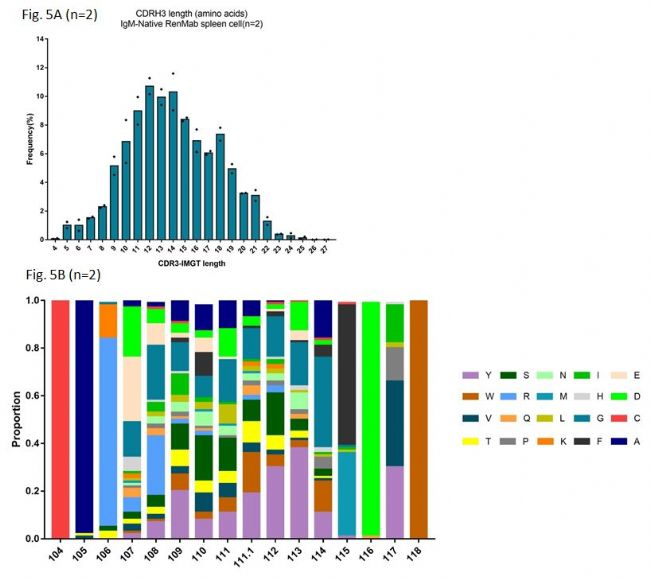
图4和图5应该解决了同学们关于RenMabTM鼠中是否能够利用人抗体的V区基因产生可变区全人源抗体的疑问。话不多说,给出示两个RenMabTM鼠抗体发现实例:
和野生鼠一样,RenMabTM鼠能产生强免疫应答
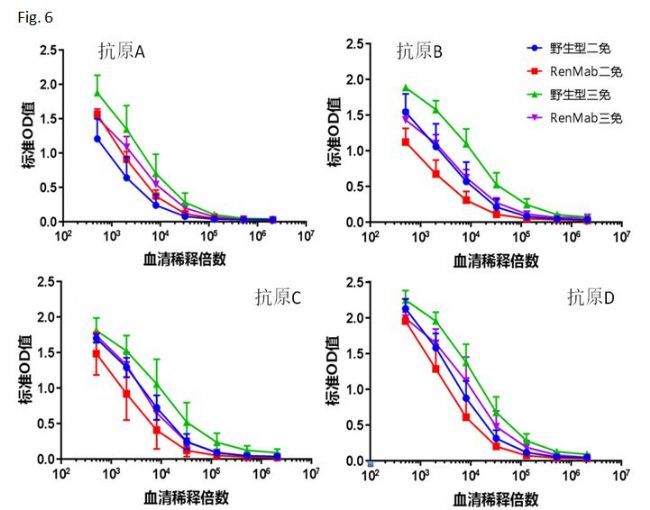
Fig. 6中显示了用四种不同种类的抗原免疫野生鼠和RenMabTM鼠的抗体滴度效价检测结果。这个试验使用了经典的“初始免疫-加强免疫”的免疫策略。从抗体滴度检测结果来看,四组RenMabTM鼠都针对相应的抗原产生了强免疫应答。相对于野生鼠,RenMabTM鼠抗原特异性的抗体滴度稍微弱一些,但是不会对抗体发现造成决定性的影响。如果您了解Trianni鼠的相应数据(Trianni鼠比野生鼠免疫后抗体滴度低五倍),我想您睡觉都会笑醒。讲到这里,RenMabTM鼠这座矿到底是贫矿还是富矿小伙伴们心里都有数了。
百奥赛图最近引入了美国Berkeley Lights公司的Beacon单细胞光导筛选平台,结合RenMabTM鼠,全人源抗体发现的进程会大大缩短。Beacon单细胞光导筛选平台结合体外噬菌体展示技术筛选RenMabTM鼠免疫文库会确保整个免疫组库中所有抗原特异性的抗体都被一网打尽。此外,RenMabTM鼠的兄弟:共同轻链鼠RenLite已经上线,VH纳米鼠RenNano也很快会亮相。百奥赛图RenMabTM鼠、RenLiteTM鼠和RenNanoTM鼠三兄弟会满足新药研发的各种需求,不仅仅是传统意义上的单克隆抗体,而且是单价双特异性抗体。VH纳米鼠RenNanoTM会使得新药研发更具有穿透力,使得大分子药渗透到实体瘤的内部或者是穿过血脑屏障成为可能。
也就是说,矿有了,矿脉找到了,最先进的挖矿工具和理念具备了。下一步,您说呢?还等什么,赶快收拾铺盖卷过来一起来百奥赛图挖矿啊,再晚了钻石开采权就没了。