器官选择性mRNA递送系统的机制,扩展mRNA和CRISPR技术应用
近年来,mRNA作为新型制药技术,短时间内在传染性疾病及肿瘤治疗领域取得了突破性进展。然而,如何将mRNA药物安全、高效地递送到特定靶细胞并保护其免于降解是目前mRNA疗法的主要障碍之一。

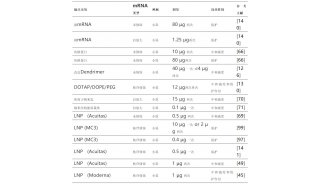
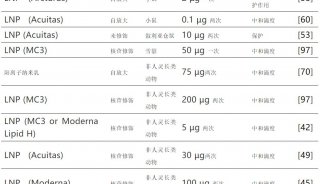
理想的递送载体必须是安全的、稳定的和器官特异性的。脂质纳米颗粒(LNP)是目前临床上最先进的mRNA递送载体。目前,所有正在研制或批准临床使用的新冠mRNA疫苗均采用LNP载体进行递送。LNP为mRNA递送提供了许多好处,包括制剂简单、模块化、生物相容性和较大的mRNA有效载荷。
然而,临床研究表明,LNP会在肝脏积聚,因此当前的LNP递送系统大多是肝脏靶向的,肝脏以外器官(如肺和肾)的有效递送问题亟待解决。
美国德克萨斯大学西南医学中心 Daniel Siegwart 教授、程强博士(现为北京大学未来技术学院研究员)作为共同通讯作者,在《美国科学院院刊》(PNAS)上发表了题为:On the mechanism of tissue-specific mRNA delivery by selective organ targeting nanoparticles 的研究论文。
该团队之前开发了一种选择性器官靶向脂质纳米颗粒,并将其命名为SORT(selective organ targeting),通过添加新的脂质SORT脂质,可实现对肝脏、肺、脾等器官的特异性靶向。
该研究进一步解析了这种选择性器官靶向脂质纳米颗粒能够实现组织特异性递送的具体机制。这将大大扩展mRNA疫苗和药物,以及CRISPR基因编辑疗法的应用范围。
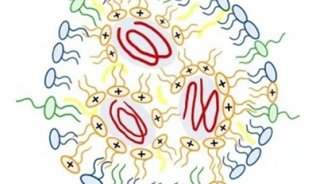
脂质纳米颗粒(LNP)通常包括四种成分,可电离脂质、胆固醇、辅助磷脂和聚乙二醇化脂质,这些成分与mRNA在酸性缓冲液中形成纳米颗粒,共同封装和保护脆弱的mRNA。此外,它们在内涵体的酸性环境中带正电荷,这促进了它们与内涵体膜的融合,将其释放到细胞质中。
在这篇 PNAS 论文发表之前,Daniel Siegwart 教授团队发现,在脂质纳米颗粒中添加第五种成分——SORT脂质,可以改变LNP在体内的器官靶向特性,并实现mRNA对肝脏以外器官的递送。更重要的是,这种SORT-LNPs可推广到多种肝外器官组织,实现对肺、肾脏乃至上皮细胞和免疫细胞等的mRNA递送。
这项研究成果于2020年4月发表于 Nature Nanobitechnology 期刊,程强(现为北京大学未来技术学院研究员)、魏妥(现为中科院动物所研究员)为论文共同第一作者。
该论文已经发表就引起医药领域广泛关注,但是,SORT-LNPs的作用机制仍未明确。因此,在这篇 PNAS 论文中,为了理解SORT-LNPs如何突破肝脏积聚的递送屏障,研究团队研究了定义其器官靶向特性的机制因素。
研究团队首先根据确定肝靶向LNPs功效的三个既定原则,识别并研究了可以解释SORT-LNPs的器官靶向特性的机制因素:器官水平生物分布、酸解离常数(pKa)和血清蛋白吸附。
研究团队发现,这三个因素在不同器官靶向的SORT-LNPs中是不同的,并与它们的组织靶向特性相关。例如,肝靶向LNPs的酸解离常数(pKa)接近6.4,载脂蛋白E(ApoE)在LNP表面的吸附。
用于组织特异性mRNA递送的SORT纳米颗粒具有独特的生物分布和电离行为
此外,研究团队提供了血清蛋白在组织靶向上的功能作用的三步机制的证据:首先,LNP表面PEG脂质的解吸暴露了LNP中潜在的SORT分子。接下来,不同的血清蛋白识别暴露的SORT分子,并吸附在LNP表面。最后,表面吸附蛋白与靶器官中细胞表达的同源受体相互作用,以促进mRNA的功能性传递到这些组织。
这些发现在SORT纳米颗粒的分子组成和它们独特而精确的器官靶向特性之间建立了一个关键的联系,并表明SORT分子的选择决定了哪些蛋白质可以吸附在LNP表面,从而影响了SORT-LNPs的递送终点。
总而言之,这项研究解释了SORT-LNPs实现器官组织特异性递送的具体机制,这将推动SORT-LNPs在肺、肝和脾等组织器官中的治疗应用优化,并为将SORT平台扩展到其他纳米颗粒类型、生理组织和细胞类型奠定基础。
-
焦点事件

-
项目成果