血球计数板的误差来源
血球计数板一直是实验室细胞计数的金标准。早在18世纪的法国,医生就开始用血球计数板分析病人的血液样本。经过100多年的不断改进,如今的血球计数板相比其原型在准确性和便捷程度上都有了大幅提高,成为了现代细胞学研究的重要工具之一(对该历史感兴趣的小伙伴,请参考《血球计数板的前世今生》)。然而,因血球计数板固有的设计和使用方法带来的计数误差依然存在。相信不少小伙伴都有为忽高忽低的计数结果抓狂和被巨大的CV值所震惊的经历…… 今天我们就来谈谈血球计数板的误差来源以及如何避免或降低这些误差。
血球计数板的计数误差主要来自于三个方面:
● 随机误差
● 人为误差
● 系统误差
随机误差
随机误差又叫偶然误差,是即使在完全消除系统误差这种理想情况下,多次重复测量同一对象,仍会由于各种偶然的、无法预测的不确定因素干扰而产生的测量误差。简言之,这类误差是一种自然规律,是无法避免的。
1881年,统计学家Lyon和Thoma推算出血球计数板的随机误差公式为:
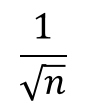
其中n为所计算的细胞数
1907年,以发明了Student’s t-test而闻名的Willian Seal在一篇文献中推导出了同样的公式 [1, 2]。下表是用标准Neubauer型血球计数板测量不同浓度的细胞样本时4个大方格的细胞数和理论随机误差:
可见细胞浓度越高,检测细胞数越多(即样本量越大),随机误差越低。因此,为了降低随机误差,我们可以:
- 提高细胞浓度(浓缩样本)
- 增加检测细胞数量(多数几个大方格)
- 增加重复检测的次数
增加细胞浓度和计数总数可以降低随机误差,但是浓缩步骤会引入新的误差,操作者也需要花更多的时间用于计数。流式细胞仪或基于成像原理的自动细胞计数仪可在短时间内分析大量细胞(比如Cellaca
MX一次计数的视野要远远大于血球计数板,分析最快只需2秒),提高效率的同时降低了随机误差。另外,仪器可以测量的浓度范围比血球计数板更广(比如Cellometer细胞计数仪的检测范围为1x10^5
– 1x10^7细胞/ml),可以省去浓缩或稀释步骤。
人为误差
有的小伙伴可能会说,我的样本浓度应该有1x10^6细胞/ml,但为什么我计数的CV值有时候会超过30%呢?这个锅,统计学家们可不背!细胞计数误差的另一个重要来源就是人为误差。早在1964年统计学家Fruend和Carol就发表文献指出不同操作者检测同一样本的计数差异可高达52% ;同一操作者不同次计数间的差异也可达到20% [3]。是不是触目惊心?
人为误差有哪些呢?该怎样减少或避免呢?我们一条一条来看。
混匀
混匀所用的体积至少为溶液总体积的20%。比如混匀1 ml的溶液,需要将移液器体积调到至少 200 µl。试想如果用10 µl的移液器去混匀1 ml的细胞悬液,会有怎样的后果?
枪头尖端应放置在溶液的中部,不要离液面或底部太近
移液器上下吹打10次,力度适中,避免产生气泡。成团严重的细胞可增加吹打次数
从较大容器(比如T25、T75烧瓶)中取样时,应先用5 ml或10 ml移液器混匀,取出样本加入较小容器(比如离心管)后再用小量程的移液器和枪头继续吹打混匀
稀释和取样
确保稀释倍数计算正确
原液混匀后应立刻取样,避免细胞沉淀。如果等待时间过长,应重新混匀再取样
如果稀释倍数很高(比如1:100甚至1:1000),建议梯度稀释(比如连续做2到3次1:10的稀释),避免原液体积过小造成误差
同一样本的重复取样应在短时间内完成。如果时间过长,应重新混匀再取样
计数
细胞判断标准必须统一
活细胞和死细胞如何定义?
压线细胞如何数(数上不数下?数左不数右?)
成团细胞数一个还是分开数?
混匀、稀释和取样都是生物实验的基本操作。除了细胞计数,这些基本功在其他的实验中也是必不可少的。所以小伙伴们要好好修炼啊!当然,如果你的实验室是土豪级别,可以用自动化设备(比如液体工作站)完成这些操作,那也是极好的。
细胞的判断标准是计数误差来源中主观性最强的一个因素。即使有统一的标准,在执行时也难免有所偏差,所以才会出现前文提到的触目惊心的操作者之间和不同次计数间的差异。自动细胞计数仪由软件的参数定义和识别细胞,判断标准不会随人、时间或其他条件而改变,可以完美解决这一问题。
系统误差
系统误差是非随机误差,是由测量与分析过程中某些固定的原因引起的一类误差,它具有重复性、单向性和可测性。就如同打靶时如果每次都击中同一区域,但都离靶心相去甚远,那么击中的区域到靶心的距离就是系统误差。
在细胞计数中,我们可以把随机误差和人为误差控制到最低,得到很好的可重复性(即很小的CV值,很高的精密度),但是测得的结果有可能和实际值仍有差异(即较差的准确度)。此时就需要考虑到系统误差,主要包括血球计数板的品牌、工艺和规格以及其他器材的选择。
血球计数计数板
市面上的血球计数板质量参差不齐,不同的工艺水平导致不同品牌的计数板之间存在着规格差异。
必须从正规渠道购买正规品牌的血球计数板
血球计数板的盖玻片必须使用原装配套的。盖玻片的材质、重量和尺寸的变化会直接影响计数室的高度和体积
盖玻片须摆放正确以确保加样体积准确
使用过的血球计数板必须清洗干净、晾干后再使用,避免样本间交叉污染
血球计数板属于精密设备,在使用时有诸多细节需要注意,步骤繁琐。而且每次只能加载两个样本,耗费精力,效率低下。一次性标准规格的计数板(比如Cellometer计数板)的体积和计数面积固定,在出厂时都经过精密测量,不存在使用不当造成的差异,也避免了样本间的交叉污染。结合使用细胞计数仪能大幅缩短计数时间,提高工作效率。
其他器材
使用校准过的移液器以确保取样体积准确
使用低吸附枪头和离心管以避免细胞和溶液挂壁
看完了今天的分享,小伙伴们是不是对细胞计数有了更深的了解?当有人向你提出诸如“用血球计数板数1x10^5/ml浓度的样本时CV也必须达到5%以下”的“无理要求”时,你知道该怎样用科学的态度予以回应了吧?如果你仍心有疑虑,或对方依旧不服,欢迎留言或致电021-58860038,Nexcelom的应用科学家们会非常乐意和大家继续探讨这个有趣的话题。
参考文献
1.Student. On the Error of Counting with a Haemacytometer. Biometrika 1907; 5(3): 351-60.
2.Shapiro HM. "Cellular Astronomy" - A Foreseeable Future in Cytometry. Cytometry Part A 2004; 60A:115-24.
3.Freund M, Carol B. Factors Affecting Haemocytometer Counts of Sperm Concentration in Human Semen. Journal of Reproductive Fertility 1964; 8: 149-55.




















