等温扩增技术(isothermal amplification technology,ITA)是近年来发展起来的基于恒温扩增的新型核酸扩增技术,主要包括环介导等温扩增(loop-mediated isothermal amplification,LAMP)[1]、交叉引物扩增(crossing priming amplification,CPA)[2]、链替代扩增(strand displacement amplification,SDA)[3]、重组酶聚合酶扩增(recombinase polymerase amplification,RPA)[4]、依赖核酸序列的扩增(nucleic acid sequence-based amplification,NASBA)[5]、滚环扩增(rolling circle amplification,RCA)[6]和依赖解旋酶的扩增(helicase-dependent amplification,HDA)[7]。尽管各种等温扩增技术均采用恒温扩增,但引物设计与扩增原理差异较大,本文就其原理、特点及应用进行综述。
2000年,日本学者Notomi等[1]报道了LAMP技术。LAMP在60~65 ℃条件下进行[8],需要4条引物和具有链置换功能的嗜热脂肪芽孢杆菌DNA聚合酶(DNA
polymerase of Bacillus
stearothermophilus,BstDNA聚合酶)。外引物与PCR引物类似,而内引物则含有两段序列。过程如下:(1)内引物结合目的基因,在BstDNA聚合酶的作用下延伸为双链。外引物与双链DNA的5′端结合,在一端形成环状结构。另一端经过同样过程,形成两端为环的哑铃状结构。(2)哑铃状结构的单链DNA具有模板与引物的双重功能,在Bst聚合酶的催化下即能延伸。(3)内引物也能与环状结构结合,在酶的作用下进行延伸[9]。
LAMP的优点为特异性和灵敏度高;扩增产物可通过电泳、电化学传感器、横向流动试纸条等方法判定结果[10]。局限性在于引物设计繁琐,易出现非特异性扩增,可通过标准化引物和调整缓冲液浓度克服此缺点[11]。
LAMP可用于病原体检测,Lin等[12]利用LAMP技术检测呼吸道样本中的耐甲氧西林的金黄色葡萄球菌,该方法检测16s RNA基因检测限为104 CFU/ml(CFU为菌落形成单位),mecA基因检测限为105 CFU/ml;Ulep等[13]开发了一个基于液滴LAMP的检测平台,定量检测5%稀释血液样本中的O157:H7型大肠杆菌,其检测限为10 CFU/μl。改良LAMP用于检测肺孢子虫,与其他常见肺部感染无交叉反应,且比常规PCR灵敏度高1 000倍[14]。此外,LAMP还可用于人乳头瘤病毒检测[15]、食品中肠炎沙门菌检测[16]等。LAMP还可用于癌症中突变基因的检测,Itonaga等[17]利用肽核酸-锁核酸(peptide nucleic acid-locked nucleic acid,PNA-LNA)介导的LAMP检测胰腺癌细胞系中的基因突变,可在突变野生比为0.1%的情况下检测突变基因。Raack等[18]利用肽核酸介导的LAMP分析法,检测经细胞裂解液处理的口腔拭子样本中的基因突变,并显示出比Sanger测序更好的灵敏度。
CPA在63 ℃左右进行,依赖Bst DNA聚合酶、甜菜碱和交叉引物。根据交叉引物数量的不同,可分为双交叉引物扩增和单交叉引物扩增。双交叉引物扩增使用两条交叉引物和两条剥离引物。两条交叉引物分别与模板链互补结合后延伸,随后剥离引物在Bst DNA聚合酶的作用下将新合成的单链剥离,最后两条交叉引物在Bst DNA聚合酶的作用下以新生单链为模板合成大量目的片段[2]。单交叉引物扩增使用一条交叉引物、两条剥离引物和两条普通引物。首先交叉引物与模板链结合并延伸为双链,而剥离引物在Bst
DNA聚合酶的作用下将新链与模板分离;随后普通引物以新链为模板,合成两条不同长度的单链DNA;最后以这两条单链为模板,以交叉引物与普通引物为引物对,形成扩增循环。
CPA最显著的优点是有极高的灵敏度和特异性[19]。缺点在于引物复杂、假阳性率高。
由于灵敏度高,CPA主要用于微量病原体核酸的检测:Qiao等[19]采用CPA和免疫印迹法检测葡萄球菌的凝固酶基因,检出限为3 627 fg(1 fg=10-15g);Meng等[20]采用CPA检测嗜水气单胞菌,检出限约为5×103 CFU/g。反转录交叉引物扩增结合核酸检测试纸条还可用于猪流行性腹泻病毒的检测[21]。SDA的反应温度约为37
℃,反应需要限制性核酸内切酶、链置换DNA聚合酶和两对引物,且其中一对引物(P1和P2)含有内切酶识别序列。反应开始时P1和P2与模板链互补结合,在聚合酶的催化下延伸为双链,随后内切酶识别双链两端的酶切位点,切割形成黏性末端。第二对引物结合模板链末端,在聚合酶的作用下合成新链同时置换出一条单链[3]。
SDA反应时间短(约15~20 min),与横向流动试纸条、荧光免疫技术等结合,可实现即时检测[22]。但需昂贵的酶类和非标准核苷酸、不能完成长片段的扩增,且产物两端还残留核酸内切酶的识别序列[3]。
SDA可用于蛋白质的检测,Zhang等[23]使用荧光SDA方法扩增生物素和链霉亲和素结合后形成的特异性序列,进行信号放大,从而实现链霉亲和素的检测,该方法检测限为92 pmol/L。SDA结合荧光或横向流动试纸条可用于快速检测病原菌,Toley等[24]利用SDA技术开发了金黄色葡萄球菌的检测试纸条,检测限低至每5拷贝/μl;Du等[3]基于SDA开发了检测尿嘧啶-DNA糖基化酶活性的传感平台,检测限为1×10-4 U/ml(U为酶的活性单位)。
RPA的反应温度为37~42
℃,反应体系包括1对引物和3种关键酶:能与寡核苷酸引物结合的重组酶、单链DNA结合蛋白(single strand DNA-binding
protein,SSB)和链置换DNA聚合酶。反应开始时引物与重组酶结合形成引物重组酶复合物,并与模板链上相应位点互补结合,导至双链DNA构象发生改变,并在具有链置换特性的DNA聚合酶的催化下延伸形成完整双链。反应时单链结合蛋白结合游离单链,保持其稳定性[4]。
RPA有很高的特异性和扩增效率,冻干试剂也可用;但扩增体系存在大量酶类,去除蛋白后才能电泳或后续试验[4]。
RPA可用于病原体的检测和突变基因的检测,Kersting等[25]建立了肺炎球菌和嗜肺军团菌的双重RPA,用于非典型肺炎的快速诊断,25 min即可完成检测,灵敏度可达0.2 CFU/μl;RPA与横向流动试纸条结合,用于检测环境中的弓形虫[26]。Martorell等[27]利用RPA对癌细胞磷酯酰肌醇3-激酶(phosphatidylinositol 3-hydroxy Kinase,PIK3CA)基因的野生型及其突变型进行检测,并对扩增产物进行快速杂交测定和比色测定,可在95%的野生型DNA的背景下识别特定突变。NASBA技术是检测RNA的等温扩增方法,通常在42 ℃左右进行[28],需要AMV(avian
myeloblastosis virus)逆转录酶、RNA酶H、T7
RNA聚合酶和一对引物来完成。其正向引物包含T7启动子互补序列。反应过程中正向引物与RNA链结合,由AMV酶催化形成DNA-RNA双链;RNA酶H消化杂交双链中的RNA,保留DNA单链;在反向引物与AMV酶的作用下形成含有T7启动子序列的DNA双链;在T7
RNA聚合酶的作用下完成转录过程,产生大量目的RNA[5]。
NASBA的优点在于产物是单链RNA,不易造成遗留污染;由于转录过程产生大量RNA,具有更高的灵敏度;将反转录和扩增反应一步完成,适用于RNA样品的分析[27],缺点是需用RNA酶抑制剂防止RNA降解。
NASBA可用于病原体(尤其是RNA病毒)检测。基于艾滋病毒RNA的NASBA的数字化芯片可用于量化人血浆样本中的病毒载量,可检测低至10拷贝/μl[29]。Clancy等[30]用荧光标记的探针实时检测流感嗜血杆菌、脑膜炎奈瑟菌、肺炎链球菌三重非竞争NASBA的扩增产物,用于诊断细菌性脑膜炎,该方法特异性为100%,3种细菌的检出限分别为55.36、0.99和57.24个细胞当量。实时定量的NASBA还可用扩增灭活卵囊中的MIC1
mRNA,检测并区分人畜共患的小隐孢子虫和人隐孢子虫[31]。RCA借鉴了自然界中环状DNA复制方式。所需酶为phi29DNA聚合酶,在37 ℃左右进行[32]。普通RCA的过程为:引物与环状DNA模板结合后延伸,生成含有大量目的基因的DNA单链[6]。在此基础上还发展出了多种改进技术,如多位点同时进行扩增的多引物RCA[6]、使用两条引物提高扩增效率的指数RCA [33]。
RCA的优点有:扩增效率高;种类多,应用广;产物为单链DNA,能与探针直接结合实现信号放大[33]。局限性在于所需模板为环状DNA。
RCA及其改进技术有着广泛的应用。RCA产物经纳米材料信号放大,结合生物传感器,用于检测双酚A含量,检测限为5.4×10-17 mol/L[34];切口增强RCA结合生物传感器和荧光,用于检测miRNA(microRNA),检出限为10 pmol/L[35];超支化RCA结合分子信标与荧光,可以定量检测低至1×10-18 mol/L的miRNA-21[36];Ciftci等[37]设计了一种基于RCA的检测方法,结合链霉亲和素-生物素系统,在电极网上通过葡萄糖氧化酶催化产生H2O2,将化学信号转化为电流信号,检测埃博拉病毒RNA,检出限为10 pmol/L。
HDA模拟体内DNA半保留复制过程,该反应在37 ℃左右进行,依赖于解旋酶、SSB、DNA聚合酶以及一对引物[38]。过程为:DNA双链在解旋酶的作用下解开,SSB与单链DNA结合保持其稳定;同时引物与单链结合,在聚合酶的催化下形成双链;新合成的DNA双链作为模板进入新一轮扩增[7]。
HDA的优点是反应迅速,灵敏度高;全程恒温[38];可直接用于热处理裂解后的鼻咽拭子等样本[7]。缺点是受解旋速度限制,只能扩增短片段;易产生引物二聚体,脱靶杂交体和非规范的褶皱等[39]。
HDA可用于病原体的检测:Barreda-García等[40]利用不对称HDA,磁性包裹扩增的单链DNA,结合电化学系统,能量化低至15个拷贝的结核分枝杆菌基因组DNA;固相HDA结合电化学传感器可用于沙门菌的检测,检出限为10个拷贝[41]。HDA扩增反刍动物相关的拟杆菌16S rRNA,结合横向试纸条可用于检测反刍动物粪便污染源[42]。HDA还可用于miRNA的定量检测:靶miRNA与线性DNA 3′末端特异性杂交形成DNA-miRNA异源双链体,保护探针免受核酸外切酶的消化,随后可以通过HDA技术扩增剩余的探针,在30 min内产生超高荧光信号,检测限为12.8 fmol/L[43]。
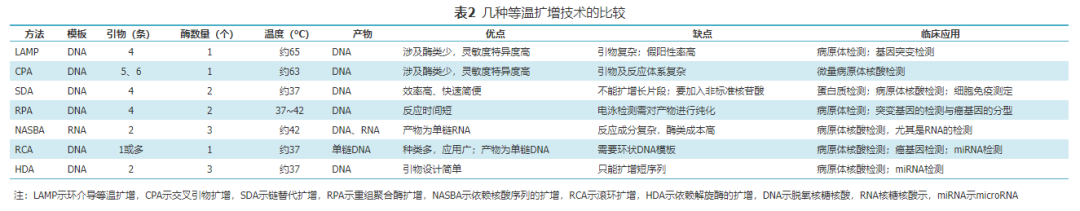
与传统PCR技术相比,等温扩增技术在原理、特点、临床应用有所不同,见表1。除此之外,各种等温扩增技术之间也有很大差异,见表2。
由于快速灵敏、简单便携,ITA在分子诊断,尤其是床旁检测及实地筛查方面有非常好的应用前景,便携化、精准化、自动化方法正在研究中[44]。ITA结合分子信标(荧光标记的寡核苷酸链),可实现实时荧光定量检测,且具有高灵敏度和特异性[45];结合微流体芯片技术,将反应过程转载到由液相小室组成的芯片结构上,再由荧光、电化学和质谱等手段,实现对样品的快速、准确和高通量分析[46];结合电化学传感器或生物传感器,可通过智能手机等实现检测数据的实时显示和在线存储[47]。



























