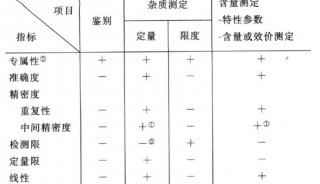
《中国药典》2015版对药品质量检定的影响(二)
【有关物质】
由于现在的液相色谱工作站已经可以自由缩放,因此关于记录仪灵敏度的要求在品种正文中进行了删除,已经不做具体要求了。这说明在进行质量标准起草时,不必再出现“调节检测灵敏度,使样品色谱峰的峰高为满量程的10%-20%”这种写法。
凡例中已规定:制剂的所有已知杂质应全部在原料药标准中列出,但一定要注意杂质序号的变化,同序号的杂质应确认是否相同,制剂项下的已知杂质引用时采用“原料药名称+杂质名称”如“阿卡波糖杂质I”;复方制剂的主成分以及主药与辅料相互作用产物,还列在各品种项下,如异福片中利福平与异烟肼的结合产物:利福霉素异烟腙(HYD);地塞米松磷酸钠注射液中地塞米松磷酸钠与抗氧剂亚硫酸氢钠的作用产物:16α-甲基-11β,17α,21-三羟基-9α-氟-1β-磺酸基孕甾-4-烯-3,20-二酮-21-磷酸酯二钠盐。
原料药质量标准中杂质信息包括已知杂质的结构式、化学名以及分子式分子量,药典中以“附”的形式附在标准后面。当杂质采用相对保留时间进行定位时,一般在质量标准中应规定详细的色谱条件如色谱柱厂家、规格、流速、柱温等,主峰的保留时间也要规定;方法为梯度洗脱的,要有明确有效的分离度要求,理论板数的要求可以删除。
2015年版《中国药典》对方法的系统适用性要求更高。目前有杂质对照品法、混合对照品法、化学破坏法和相对保留时间法等增加对分离度的要求,同时通过配制灵敏度溶液增加了对方法灵敏度和报告限的要求,规范了部分积分参数的合理设置。在限度方面,2015 年版《中国药典》对原料药和制剂均要求控制工艺杂质和降解杂质,且一般对已知杂质、特定杂质、未知杂质和总杂质分别设定限度控制。
2015 年版《中国药典》对涉及到安全性的项目进行了增修订,如雷米普利标准中采用原子吸收分光光度法对催化剂钯进行控制;肝素钠标准中增订了对蛋白质和多硫酸软骨素的控制;盐酸利多卡因注射液因存在椎管给药方式,标准中增加了渗透压的控制,而且限度严格;手性固定相的高效液相色谱和手性添加剂的毛细管电泳在光学异构体杂质的控制中均有应用。伏立康唑标准中右旋异构体采用了前者采用大赛璐公司(Daicel)的Chiralpak
AS-H手性柱,佐米曲普坦标准中R-异构体测定采用了后者。毛细管电泳法在药典中的使用日益增多,常用来解决异构体拆分,也可用于无机离子检测等,目前市场上的仪器如安捷伦公司的Agilent
7100 CE可以进行多种方式的分离检测。

Agilent毛细管电泳仪
【残留溶剂】
在写法上,只有一种方法的,仅列黑体“残留溶剂”,限度中写(具体残留溶剂名称)的残留量均应符合规定;两种以上方法测不同溶剂时,黑体“残留溶剂”,后面小标题用宋体列出具体溶剂名称。在执行药典标准进行检验时,由于凡例中已增加了“对生产过程中引入”的规定,也就是说,生产企业要是有足够的证据证明并未在生产过程中使用标准中规定的残留溶剂,就可以不对标准中规定的有关残留溶剂进行检查。
【溶出度与释放度】
引用的附录由于名称变更,均改为“0931溶出度与释放度检查法”;释放介质统一改为溶出介质;释放量统一为溶出量。原释放度第三法改为溶出度第四法,对于贴剂及透皮贴剂,应重点关注。2015 年版《中国药典》的第四法分为方法1(大碟)和方法2(小碟),其中小蝶法为新增方法,生产企业应根据自己产品的特点选择,如原药典品种“雌二醇缓释贴片”,其规格为“2. 5mg(4. 0cm×2. 6 cm)”,就只能用大碟法。
随着仿制药一致性评价工作的深入,对溶出曲线及溶出现象的要求日益提高。市场上出现了一些有特点的溶出仪,如岛津公司的SNTR系列溶出度仪(SNTR-6400A、SNTR-8400A 和 SNTR-8400AT),通过灵活丰富的配置方案,可实现与分析仪器如UV-1800的联用,便于样品收集和数据分析,同时还能够连接视频记录系统,实时监控和记录每个溶出杯中的样品状态及释放过程,便于追溯和查找异常数据产生原因。



岛津SNTR溶出度仪
【水分】
2015 年版《中国药典》相关通则将原水分检查法的第一法 A和B,分别改为第一法1和2,故需进行相关的替换。
【含量测定】
当色谱方法同时用于鉴别时,供试品溶液写法应为“……,作为供试品溶液”。仅活性部分出峰时应明确出峰的确切成分是什么(有机酸成酯的除外),如盐酸麻黄碱出的峰应为麻黄碱峰,醋酸地塞米松出的峰为醋酸地塞米松峰。
【规格】
多规格药品,按(分子式)计列在具体规格的前面,如盐酸美他环素胶囊,“按C22H22N2O8计(1)0. 1,(2)0. 2 g”;单规格的,则列在具体规格之后,如盐酸舍曲林胶囊,“50 mg(按C17H17Cl2N计)”。由于药典收载的规格不可能包括所有已上市的产品规格,按照 2015 年版《中国药典》实施公告(总局2015年第105号文),企业需根据各自的产品规格,对标准中规格影响操作的项目进行必要的规范后亦应执行药典标准。