基因疗法开创!帕金森病终于有救了?
中国科学院深圳先进技术研究院路中华、戴辑、鲍进团队的最新研究成果发表于顶刊《细胞》上,为帕金森病的精准治疗提供了全新策略。
他们结合基因工程和化学遗传学技术,成功开发出一种可以选择性调控帕金森病相关的特定神经回路的治疗方法。非人灵长类动物实验验证表明,这种治疗方法不仅可以有效缓解帕金森病症状,还能够避免左旋多巴药物长期治疗引发的异动症,实现精准、高效。

论文首页截图
大脑纹状体中,存在表达D1型多巴胺受体的中棘神经元(D1-MSN)和表达D2型多巴胺受体的中棘神经元(D2-MSN)。D1-MSN与D2-MSN都能够接收黑质致密部的多巴胺信号,但下游投射区域不同,在运动调控时起着相反的作用。
D1-MSN的轴突投射至黑质网状部脑区构成直接通路,负责促进运动;D2-MSN的轴突投射至外侧苍白球脑区构成间接通路,负责抑制运动。在帕金森病中,多巴胺耗竭会导致这两条关键神经回路活性失调,D1-MSN介导的直接通路活性被抑制,而D2-MSN介导的间接通路被异常激活。
已有啮齿类动物模型研究结果显示,只要使用遗传学技术特异性逆转D1-MSN的活性,便可以有效治疗帕金森病的运动症状。当然,这种方式虽说是实现了精准靶向,但完全无法适用于人类等灵长类大脑。
于是,关于如何挽救帕金森病中D1-MSN的活性,路中华、戴辑、鲍进团队想到了一招“顺藤摸瓜”——
巧妙利用逆向腺相关病毒(AAV),给逆向AAV病毒组装上适当的启动子和/或增强子以及化学遗传学元件,将其注射到黑质网状部脑区以选择性感染并标记其上游的D1-MSN,从而实现特异性地上调D1-MSN及其介导的直接通路的活性。
这招确实有效。
经过一系列尝试和优化,研究团队开发出一种能够高效感染D1-MSN的逆向AAV衣壳AAV8R12,以及能够高效驱动目标基因在D1-MSN中表达的启动子G88P2/3/7(分别为2259bp,1395bp,896bp),并且通过筛选得到与全身系统性给药相匹配的化学遗传学元件rM3Ds。
其中,启动子驱动rM3Ds在D1-MSN中表达后,其编码的蛋白rM3Ds可以通过与化合物氯氮平N-氧化物(CNO)或去氯氯氮平(DCZ)结合而激活,导致D1-MSN活性上调。
而且,逆向AAV病毒仅被注射至黑质网状部脑区,这从空间上就保证了治疗的特异性,不会妨碍到D2-MSN及其介导的间接通路。
研究团队在小鼠实验和非人灵长类动物实验(猕猴)中,验证了给药后神经元活性的改变。
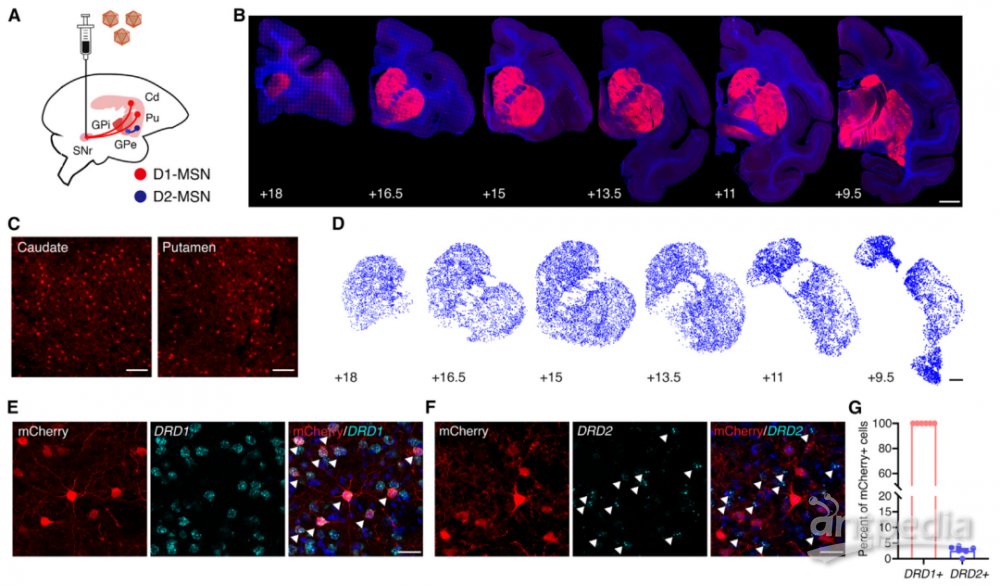
通过注射逆向AAV病毒至黑质网状部脑区,来选择性标记D1-MSN
非人灵长类动物实验结果表明,向黑质网状部脑区注射逆向AAV病毒并给药去氯氯氮平,可以极大改善帕金森病模型动物的运动障碍症状,包括动作迟缓、震颤、肌肉僵硬、姿势异常等,且表现出持久的疗效。
从安全性来看,治疗期间实验动物没有出现运动障碍,与肝脏和肾脏功能相关的血液指标保持稳定。
与传统的帕金森病药物左旋多巴相比,这种治疗方式能够更快地缓解病情,药效持续时间更长,单次给药去氯氯氮平后药效至少维持24小时,并且长期给药不会引发类似的副作用异动症。另外,即使之前已经长期(4个月)给药左旋多巴,后续再采用这种治疗方式,疗效不会受到影响。

疗效对比
现代神经科学的一个关键挑战,便是将尖端技术进展转化为有效的脑部疾病治疗方法。路中华、戴辑、鲍进团队开发的这种精准治疗方法,精妙结合了基因工程和化学遗传学,有望改变帕金森病治疗的格局,并为其它脑部疾病中对特定神经回路的靶向治疗提供启示。
让我们拭目以待这种帕金森病治疗策略的临床转化吧!