光片显微镜的前世今生
光片荧光显微镜(Light Sheet Fluorescence Microscopy, LSFM)的概念产生于1903年,但此后很长时间并无太多发展。上世纪九十年代,华盛顿大学的Francis Spelman实验室为了对小鼠毛细胞的结构和耳蜗的其他特性进行定量测量,发展了一系列实验方法。实验室研究人员受到前人使用侧向光片照明观察表面结构的启发,发明了正交平面荧光光学切片装置(orthogonal plane fluorescence optical sectioning, OPFOS),并第一次获得了整个耳蜗的清晰荧光图像(1) (2) (3)。2004年,SPIM(Single plane illumination microscopy )文章的发表大大促进了光片显微镜的发展和使用(4),文章强调了其用于胚胎发育研究的实用性,并给出了青鳉神经节细胞搏动以及果蝇胚胎发育长时间成像的荧光图像。 2010年,在第一届光片荧光显微镜研讨会上,研究者们决定将LSFM作为这一类显微镜的统一名称(5)。后续又出现了很多形式的光片显微镜,如扫描光片(6)、双光子扫描光片(7)和bessel beam(8)、lattice(9)等新式光片显微镜。这些方法不断改善光片显微镜的成像分辨率、穿透深度和成像视野,以期满足生物学发展的需要。
光片显微系统成像原理
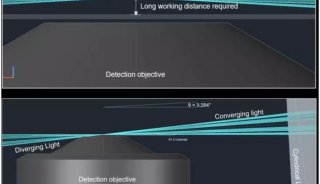
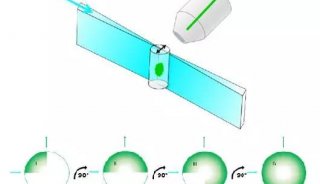
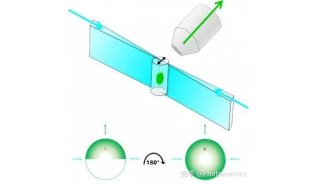
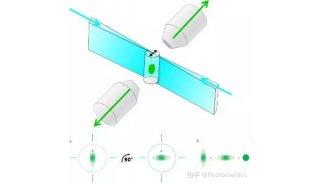
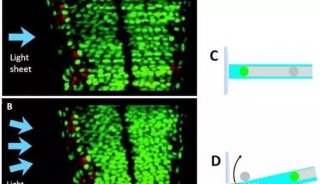
光片显微系统使用一层光束从样品侧面激发荧光样品,使用CCD或SCMOS进行检测,照明光路和荧光检测光路互相垂直。由于样品受激发的平面就是成像平面,不存在离焦激发,可以自动获得光学切片,从而将光漂白和光学损伤降到最低。光片显微系统使用CCD或SCMOS成像,速度通常为每秒几十帧,甚至上百帧,所以通过在光片下移动样品使入射光束激发不同的平面,可以很容易又非常快速的得到整个组织的3D图传统共聚焦的激发和检测是同一个方向,整个照射区域都处于被激发状态,没有被检测的区域经过长时间的照射易被淬灭,无法保证几天的记录;另外共聚焦使用点扫描成像,速度相对较慢。
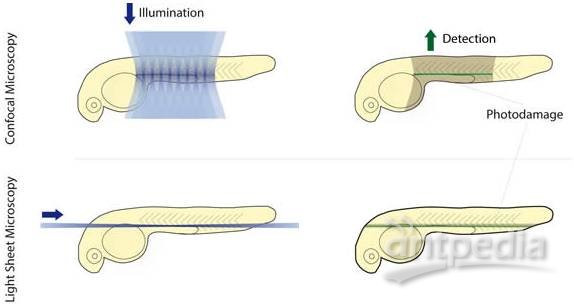
光片荧光显微镜与共聚焦显微镜的区别
2015年,Leica推出了自己的光片系统,该系统使用独特的 TwinFlect 反光镜装置使激发光束从左右两个方向入射到样品上,照明均匀,保证了细胞水平的分辨率。成像速度快、分辨率高和光毒性低的特点可使样品在该系统中保持其生物活性,完成数小时乃至数天的长时间活体生物培养及成像。另外,Leica光片系统以共聚焦为基础,可以实现与共聚焦显微镜的联合使用,完成光激活、光转换等操作及后续追踪的实验。

Leica光片显微系统常见应用
胚胎与小型生物(如模式动物斑马鱼、线虫、果蝇等,植物拟南芥等)发育过程中的快速三维成像,例如:细胞迁移、心脏及血管发育、神经发育等。
三维细胞培养、球体和囊肿、组织培养、器官培养的实时成像。
结合共聚焦或双光子激光显微镜,完成光学刺激与追踪的功能,观察和实验方式更为灵活多样。
1. 快速3D成像
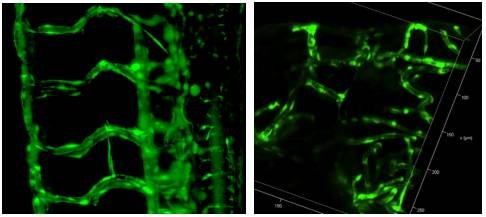
斑马鱼血管系统3D重构
2. 活体快速长时间3D成像,捕捉整个动态过程
高速成像:斑马鱼跳动的心脏
果蝇背部闭合过程
3. 唯一可以结合共聚焦和光片的系统,实现光学操作的后续追踪
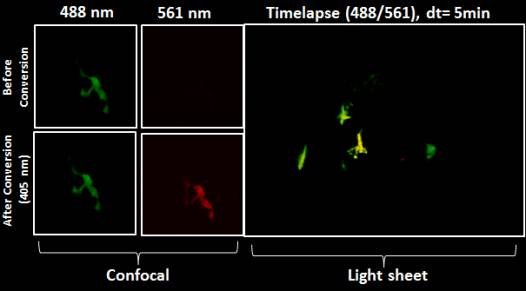
斑马鱼神经元光转换(Kaede)后,持续记录该细胞的运动
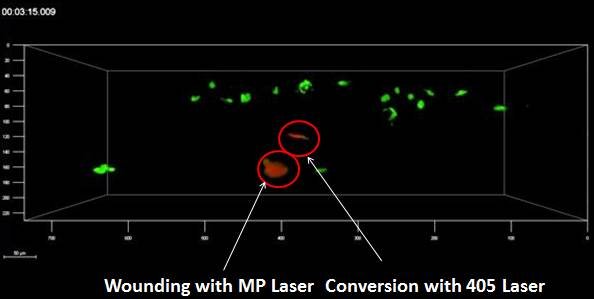
斑马鱼尾部,光转换(Kaede,405 nm)后细胞去修复被多光子激光造成的损伤部位
使用LAS X 3D分析追踪光转换的细胞

长时间的图像采集需要维持样品的活性,Leica光片系统可加载孵育装置,为样品提供良好的生长条件,保持活性。另外整个系统的开放性很高,有更多可操作的空间。
参考文献
1.Voie AH, Burns DH, Spelman FA.(1993) Orthogonal-plane fluorescence optical sectioning: three-dimensional imaging of macroscopic biological specimens. J Microsc. Jun;170(Pt 3):229-36.
2.Voie AH, Spelman FA. (1995) Three-dimensional reconstruction of the cochlea from two-dimensional images of optical sections. Comput Med Imaging Graph. Sep-Oct;19(5):377-84.
3.Voie AH. (2002) Imaging the intact guinea pig tympanic bulla by orthogonal-plane fluorescence optical sectioning microscopy. Hear Res. Sep;171(1-2):119-128. Erratum in: Hear Res. 2003 Jul;181(1-2):144.
4.Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., and Stelzer, E. H. (2004) Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science (New York, N.Y 305, 1007-1009
5.Reynaud EG, Tomancak P. (2010) Meeting report: first light sheet based fluorescence microscopy workshop. Biotechnol J. Aug;5(8):798-804. doi: 10.1002/biot.201000177
6.Keller, P. J., Schmidt, A. D., Wittbrodt, J., and Stelzer, E. H. (2008) Reconstruction of zebrafish early embryonic development by scanned light sheet microscopy. Science (New York, N.Y 322, 1065-1069
7.Truong, T. V., Supatto, W., Koos, D. S., Choi, J. M., and Fraser, S. E. (2011) Deep and fast live imaging with two-photon scanned light-sheet microscopy. Nature methods 8, 757-760
8.Planchon, T. A., Gao, L., Milkie, D. E., Davidson, M. W., Galbraith, J. A., Galbraith, C. G., and Betzig, E. (2011) Rapid three-dimensional isotropic imaging of living cells using Bessel beam plane illumination. Nature methods 8, 417-423
9.Chen, B. C., Legant, W. R., Wang, K., Shao, L., Milkie, D. E., Davidson, M. W., Janetopoulos, C., Wu, X. S., Hammer, J. A., 3rd, Liu, Z., English, B. P., Mimori-Kiyosue, Y., Romero, D. P., Ritter, A. T., Lippincott-Schwartz, J., Fritz-Laylin, L., Mullins, R. D., Mitchell, D. M., Bembenek, J. N., Reymann, A. C., Bohme, R., Grill, S. W., Wang, J. T., Seydoux, G., Tulu, U. S., Kiehart, D. P., and Betzig, E. (2014) Lattice light-sheet microscopy: imaging molecules to embryos at high spatiotemporal resolution. Science (New York, N.Y 346, 1257998