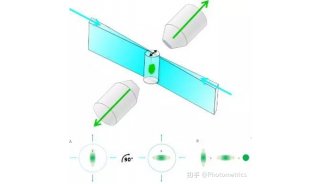
前沿显微成像技术专题之:光片荧光显微镜(一)
在过去二十多年中,光学显微成像技术发展迅速,不断突破传统极限。生命科学研究,要求成像系统在不影响生物活性的前提下,实现更大视野,更高分辨率,更高速度的三维成像。这也意味着对成像探测器 - 科研相机的要求也越来越高。
从本周开始,我们将为大家带来前沿显微成像技术专题系列,和大家一起探讨前沿的显微成像技术以及他们对科研相机的相关性能要求。
首期我们的主角是近年来广受关注和发展的光片荧光显微镜(Light Sheet Fluorescence Microscopy) 。
光片荧光显微镜的诞生
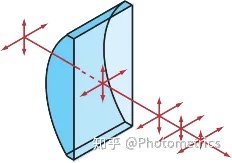
大家知道,传统的宽场荧光显微镜通过物镜将激发光聚焦,同时收集样品的荧光信号成像。观察其照明方式(图1)不难发现,虽然焦平面上的光最强,但其上下的样品也会被照亮,导致以下局限性:
引入额外的光毒性,影响样品生物活性,甚至造成细胞死亡;
成像焦平面以外的干扰信号进入图像,导致图像分辨率和反差降低。

激光扫描共聚焦使用点扫描方法,通过在探测端引入针孔,滤除了焦平面以外的杂散光,使分辨率,特别是Z轴方向的分辨率得到了提升,能够实现三维成像。但是,当激发光聚焦时,仍然会照亮上下区域(图2)。由于使用点扫描方式成像,为达到较快光的速度,光束照射每个点的时间很短,成像元件(PMT)的量子效率又很低,需要更强的激发功率。与传统宽场荧光显微镜相比,光漂白和光毒性更加严重。

1990年发明的双光子激光扫描显微镜是减少光毒性的一个好方法。由于使用近红外激光照明,对活体样品的光毒性大大降低,并且能够穿透更深的样品。但是,双光子的信号很弱,采集速度非常慢,不适合对大样品进行动态成像。而且其昂贵的成本也限制了应用范围。
听起来要同时满足大视野,高分辨率,高速度和低的光损伤是一件令人头秃的事,不过这是难不倒科学家们的。
事实上早在1903年,席格蒙迪(Richard Zsigmondy)和西登托夫(Henry Siedentopf)就发明了通过一个狭缝生成光片照明的超显微镜(Ultra microscope),但是他们的方法并未进一步发展到荧光成像。
直到1993年,华盛顿大学Voie和他的同事提出了正交平面荧光切片技术 (Orthogonal Plane Fluorescence Optical Sectioning,OPFOS)。
2004年,Ernst Stelzer和同事进一步发展了这个idea,搭建出一台新的荧光显微镜,他们称之为SPIM(单平面照明显微镜, Selective / Single Plane Illumination Microscopy),也就是我们现在所知道的光片荧光显微镜。
什么是“光片”?
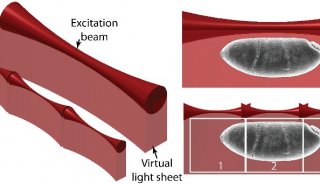
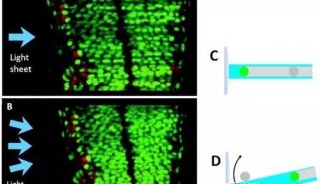
光片显微镜与传统显微镜的不同在于激发光的照明方式。它的照明光是一张与成像面平行的薄薄的“光片”(图3),只有焦平面的样品被照亮,而其上下的样品不受影响。

和传统荧光照明方式相比,光片照明有如下优点:
提高了图像和背景的反差(Signal-to-Background Ratio) 和轴向分辨率:光片照明技术保证了焦平面上下的样品不会被激发,具备和共聚焦显微镜类似的光学切片功能;
减少了光漂白和光毒性:与传统的荧光照明技术相比,光毒性可以被降低20-100倍,这样,我们就能在更接近生理状态的条件下,对活体生物样品进行长时间的三维成像;
与激光共聚焦和双光子显微镜使用低QE的PMT的点扫描成像相比,光片显微镜使用高QE的CCD或sCMOS相机进行面成像,大大提高了成像速度和图像的信噪比。共聚焦需要几分钟甚至几小时才能拍完的样品,用光片显微镜只需要几秒到几分钟。因此,光片显微镜也特别适合用于大样品成像。
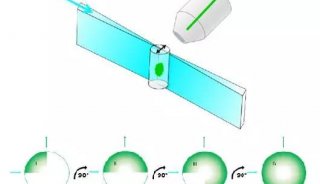
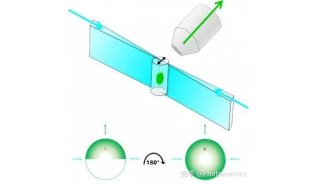
在多数光片系统中,光学元件是固定的,需要移动样品 (或使光片从xyz方向扫过样品) 来获得完整的3D图像。通过移动或旋转样品,可以对大样品进行成像,并从多个角度拍摄,将这些多视角图像通过特别算法融合在一起后,能够进一步提高图像分辨率,并修正一些光片技术特有的缺陷。
总之,光片荧光显微镜从设计原理上,大大降低了激发光对活体样品的光毒性和光漂白,天生具有光学切片能力,使用高量子效率的CCD或sCMOS探测器,是大视野,高速,高分辨率三维活体显微成像的理想工具。
“光片”的实现
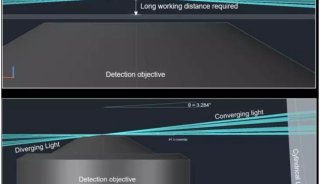
产生光片最简单的方法是在光路中引入一个圆柱形透镜。通过该透镜的光,宽度维持不变,但在高度上被压缩成平面 (图4),然后通过照明物镜,在焦面上形成“光片”。成像物镜垂直于照明物镜放置,并聚焦在光片上获取荧光信号。
使用这种方法生成的光片,其宽度和厚度由照明物镜的NA值决定。如图5所示,照明光束的实际形状是一个两头宽,中间细的“沙漏”形。ω0为光束腰厚度,也就是光片厚度,b为均匀照明宽度,也就是有效视野。
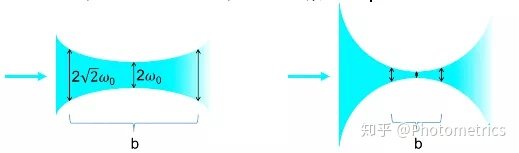
有如下公式:
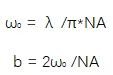
因此,使用NA较小的照明物镜,能够实现较宽范围的均匀照明,即视野更大;但是相应的,光片的厚度也越大,导致轴向分辨率降低。而高NA物镜产生的光片视野会比较小,但轴向分辨率较好。
要注意的是,如果成像物镜的NA值很高,使得其景深小于光片的厚度,那么系统的轴向分辨率主要是由成像物镜的景深决定。但这时会产生普通荧光照明时具有的问题,即焦面上下的部分样品会被照亮,不必要的光毒性和杂散光会对成像效果产生负面影响。
如果成像物镜的NA值较低,光片厚度比它的景深要小,那么系统的轴向分辨率就由光片的厚薄来决定。
好啦!说了这么多,大家对光片显微镜是否有了一个基本印象了呢?什么?有点抽象?别急,在后面几期中,我们将为大家详细介绍“光片”的各种实现方式和不同的光片显微镜应用,敬请期待!
References
Huisken J, Swoger J et al. (2004) Optical sectioning deepinside live embryos by selective plane illumination microscopy. Science. Aug 13;305(5686):1007-9
Huisken, J. & Stainier, D. Y. R. (2009) Selective plane illumination microscopy techniques in developmental biology. Development. Jun;136(12):1963-75.
VoieA. H., Burns, D. H., Spelman, F. A. (1993) Orthogonal-plane fluorescenceoptical sectioning: three-dimensional imaging of macroscopic biologicalspecimens. J Microsc. Jun;170(Pt 3):229-36.
Weber M, Mickoleit M and Huisken J (2014) Light Sheet Microscopy. Methods in Cell Biology. Jan 01; 123:193-215.