前沿显微成像技术专题之:光片荧光显微镜(三)
关于光片显微镜,通过前面第一,第二期的介绍,相信大家已经有了较为全面的了解。在本期中,我们将介绍另外几种光片显微技术,它们和第二期最后介绍的晶格光片显微镜一样,都是对传统光片显微技术的改进,以满足更高的成像要求。最后,我们将为大家总结如何挑选适合光片显微镜的科学相机。

倒置平面照明显微镜 (d)iSPIM
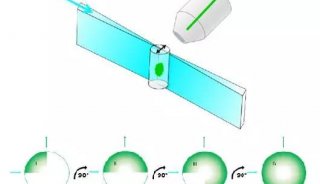
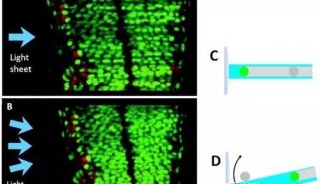
双向倒置平面照明显微镜(Dual-view inverted SPIM,diSPIM)是由NIH的Hari Shrof 实验室和 Applied Scientific Instrumentation (ASI) 公司合作开发的。它本质上是L-SPIM,通过柱形透镜来产生光片,不同的是它是倒置的,两个相互垂直,规格相同的物镜位于样品上方,浸入介质中,轮流进行照明和成像,可以达到各个方向上相同的分辨率(330nm)。iSPIM (inverted SPIM)与之原理相同,只是采用单向照明与成像,因此和其他传统光片系统一样,轴向分辨率要比横向分辨率差2-3倍。

图1 diSPIM:两个物镜轮流进行照明和成像
(d)iSPIM可以安装在任何的倒置显微镜上。采集速度可以达到200fps,信噪比和转盘共聚焦显微镜差不多,特别适用于活体3D成像。与大多数其它光片显微镜需要将样品嵌入凝胶中并悬浮在物镜之间相比, (d)iSPIM的样品制备相对比较简单,而且方便固定。通过更换介质,可以在长时间内对活体样品成像。
倾斜平面照明显微镜 oSPIM
传统的光片显微镜中,成像和照明物镜是相互垂直的,成像物镜需要和样品保持一定的距离。为防止两个物镜发生碰撞,需使用工作距离较长的低倍物镜,不适合NA值高的高倍物镜。这就为检测细胞或亚细胞水平结构带来了困难。使用传统的光片显微镜进行细胞或亚细胞水平成像,往往只能用多角度成像,再进行反卷积后处理,数据量庞大,费时费力。
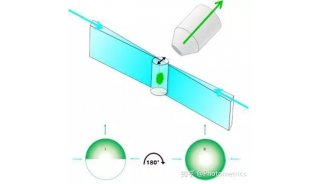
为了解决这个问题,倾斜平面照明显微镜(Oblique Single Plane Illumination Microscopy,oSPIM)应运而生。oSPIM 将照明物镜置于样品下方,以30°倾斜角生成光片。高NA值的成像物镜位于样品上方,与照明物镜成60°角,垂直于光片(图2)。这样就可以避免物镜发生碰撞,为使用高倍物镜创造了条件。另一方面,可以放置35mm以上的培养皿,为细胞和组织培养样品提供了理想的平台。
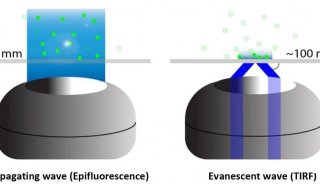
oSPIM 将光片显微镜低光漂白和光损伤的优势与高分辨率高放大倍率结合起来,可用于长时间细胞和亚细胞水平成像。同时,照明物镜也可用于常规荧光成像,如宽场、共聚焦或TIRF。这样一来,oSPIM系统可以将高分辨率荧光显微镜与高分辨率光片显微镜结合在一起,提高了系统的灵活性。

图2 倾斜平面照明显微镜 (oSPIM)
和 iSPIM 一样,oSPIM也不能达到各个方向上的分辨率一致。这时只要在样品下方使用第二个照明物镜,通过两个物镜依次生成光片(doSPIM),就可以在所有3个维度均获得良好的分辨率(每个维度低于300nm,但由于照明和成像物镜非正交,因此不完全一致)。不过,由于照明物镜倾斜,doSPIM 无法像 oSPIM 那样作为传统荧光显微镜使用。
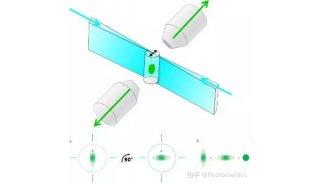
另外还有一种采用倾斜光片方法的光片显微镜——TILT Light-sheet microscopy。 它是由北卡罗来纳大学的 Paul Maddox 研究组率先开发的,现在已经由Mizar公司制造和销售。TILT 不需要照明物镜,而是利用一种称为横向干涉倾斜激励(LITE)的技术,将校准后的激发光束依次通过光罩(Photomask)和柱形透镜,聚焦成近似矩形棱镜形状的光束。然后将光片倾斜,通过这种方式,照明光片可以在非常接近成像物镜处生成(图3,下)使TILT光片系统也能够使用高倍物镜(60x,1.49)成像。
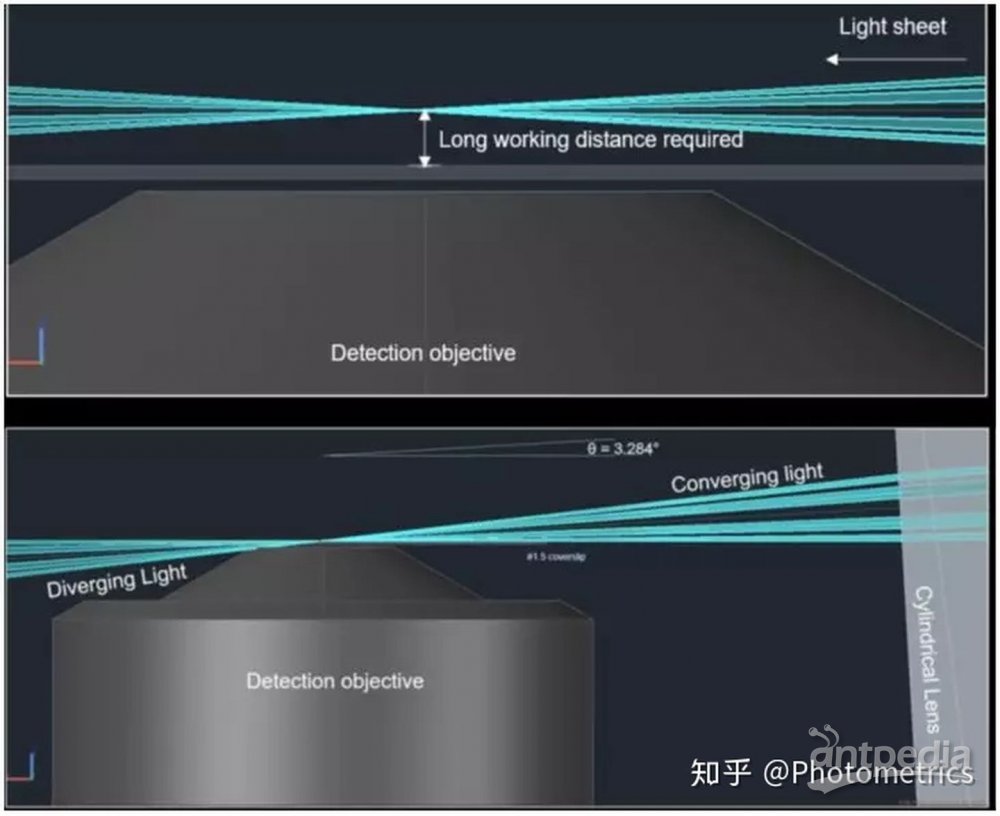
图3 传统光片照明(上)vs TILT(下)
TILT 使用的样品可以固定在玻片上,不需要特殊制备的样品,也不需要进行复杂的反卷积后处理。它可以安装在大多数正置或倒置显微镜上,还可以与微分干涉(DIC)或其他显微技术相结合使用,因此和 oSPIM 一样具有很高的灵活性。
拼接光片显微镜(Tiling-light sheet Microscopy)
在第一期中我们说过光片越薄,光学切片能力越好,轴向分辨率也越高。但是,光片的厚度和宽度是相互制约的,因此很难同时满足高轴向分辨率和大视野两个需求。为了解决这一难题,高亮等人开发了一种新的光片技术——拼接光片显微镜(Tiling-light sheet Microscopy)。通过高NA照明物镜形成薄而窄的照明光片,然后使用空间光调制器(SLM),将照明光片在整个成像视野中快速移动,将每一个位置获得的图像拼合起来,就可以得到整个成像视野的完整图像,达到“拼接”多片光片的效果(图4)——增加有效视野的同时又不损失轴向分辨率。

图4 拼接光片(Tiling-light sheet)(L Gao, 2015)
Tiling-light sheet 可根据样品及具体成像要求,对光片的厚度和拼接数量进行灵活的调整。再结合贝塞尔光束,可以快速地对大样品进行高分辨率3D成像。
光片显微镜相机选择建议
光片显微镜通常使用低倍物镜(如20x)以提供足够大的工作距离和更大的视野。为了在低倍镜下达到最高分辨率,建议使用像元较小的相机,如 4.25 μm 像元的 Teledyne Photometrics IRIS 系列等。
但是,小像元相机灵敏度相对较低,而大像元相机灵敏度更高,可以缩短曝光时间,提高成像速度。因此,相机选择要根据具体的应用和不同的光片技术综合考虑。例如,我们在前文中提到的 diSPIM,oSPIM 和 TILT 等通常使用高倍物镜(40x,60x等),我们建议使用像元更大的相机,如背照式 sCMOS Prime BSI(6.5 μm 像元),Prime 95B(11 μm 像元)。它们不仅能够提供与高倍物镜相匹配的分辨率,灵敏度也大大提升。允许减少曝光时间或降低激发光强度,进一步降低光漂白和光毒性,从而可以在更长的时间尺度上对活细胞进行成像。

图5 Prime 95B 在 TILT 光片显微镜下拍摄的表达 LifeAct-mCherry 的裂变酵母菌(150x , 1.49NA)。Prime 95B 满阱容量高达80000e-,读出噪声低至1.6e-,具有真实 16bit 动态范围,提高成像对比度。(From Paul Maddox)
Iris 15,Prime 95B 都具有对角线25mm的大视野,对大样品进行成像时可以大大减少后期工作量(图6);对小样品来说,大视野相机也可以设计为多通道同步成像。因此在满足要求的情况下,选择大视野的相机总是有好处的。

图6 Iris 15 拍摄的透明斑马鱼图像(8mmx 2mm)(FromJan Huisken's Lab)
除此之外,光片显微镜常常会用红外和近红外激发光对大样品进行深部成像,因此相机在这个近红外波段的量子效率也很重要。这时,背照式相机就有很大优势。
OpenSPIM 平台
商业化光片系统通常价格昂贵,有时也不一定能够满足特定需求,怎么办呢?德国马克斯普朗克分子细胞生物学和遗传学研究所的Peter Pitrone 和 Johannes Schindelin 以及美国威斯康星大学麦迪逊分校光学和计算仪器实验室的科学家们联合创建了OpenSPIM平台。 顾名思义,它是开源的,主要针对的是那些想尝试自己搭建光片显微成像系统的用户。在OpenSPIM主页(http://openspim.org),您可以学习有关光片显微镜的基础知识,访问自搭建系统的零件清单,阅读详细的动画版手册,并通过在线社区与其他用户进行沟通。OpenSPIM平台具有高度的灵活性,即便没有深入的光学知识,也可以通过学习自己建立起一个满足特定需求的光片系统。Teledyne Photometrics 的 IRIS 系列,Prime BSI,Prime 95B sCMOS 相机能够满足多种光片系统的要求,是您自搭建光片系统的最佳选择。
References
Abhishek, K., Wu, Y., Christensen, R., Chandris, P., Gandler, W., McCreedy, E., Bokinsky, A., Colon-Ramos, D. A., Bao, Z., McAuliffe, M., Rondeau, G. & Shroff, H. (2014) Dual-view plane illumination microscopy for rapid and spatially isotropic imaging. Nat Protoc. Nov; 9(11): 2555-2573; doi: 10.1038/nprot.2014.172
Fadero, T. C., Gerbich, T. M., Rana, K., Suzuki, A., DiSalvo, M, Schaefer, K. N., Heppert, J. K., Boothby, T. C., Goldstein, B., Peifer, M., Allbritton, N. L., Gladfelter, A. S., Maddox, A. S. & Maddox, P. S. (2017) LITE microscopy: a technique for high numerical aperture, low photobleaching fluorescence imaging. Preprint. https://doi.org/10.1101/181644
Liang Gao, Tiling light sheet selective plane illumination microscopy using discontinuous light sheets. bioRxiv (2018) 378232.
Peter G Pitrone, Johannes Schindelin, Luke Stuyvenberg, Stephan Preibisch, Michael Weber,Kevin W Eliceiri, Jan Huisken & Pavel Tomancak. OpenSPIM: an open-access light-sheet microscopy platform. Nature Methods 10, 598–599 (2013) doi:10.1038/nmeth.2507