Cell发表神经退行性疾病重要突破
最近,美国St. Jude儿童研究医院的研究人员发现,与最常见形式的肌萎缩性侧索硬化症(ALS)和额颞叶痴呆(FTD)相关的有毒蛋白,可通过一种方式使得细胞内的无膜细胞器不能工作。有毒肽可通过干扰正常的相变——这个过程可使无膜细胞器进行组装和发挥功能,直接干扰这些重要细胞器的组装和作用。相关研究结果发表在《Cell》杂志上。
这项新的工作基于St. Jude儿童研究医院发表在2015年的一项研究,这项早期的研究揭示了一种RNA结合蛋白(hnRNPA1)中的一个ALS致病突变,是如何干扰一个相同的相分离过程,这个过程可导致无膜细胞器损伤。相关阅读:Cell揭示细胞内的惊人秘密。
霍华德休斯医学研究所(HHMI)研究人员、St. Jude儿童研究医院细胞和分子生物学系主任J. Paul Taylor博士说:“我们的新发现有助于为这些使人衰弱的神经退行性疾病,建立一种更具凝聚力的分子机制图。研究人员已经确定了当这些疾病发作时细胞内许多受损的过程,但更具挑战性的是,如何将这些研究结果合并成一种统一的机制。我们的研究结果有助于解释在ALS和FTD中许多广泛存在的细胞异常,并为未来研究寻找新的药物干预奠定基础。”
ALS又称Lou Gehrig病,是一种急进性神经系统疾病,可影响负责随意肌控制的神经细胞。诊断后的平均寿命是两到五年。FTD是由大脑中的神经细胞缺失而导致的一种痴呆疾病。这两种神经系统疾病都没有治愈的方法。
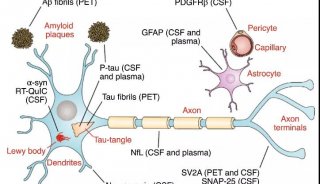
一段时间以来人们知道,位于人类9号染色体上的C9orf72基因,在ALS和FTD患者当中是受损的。“健康”基因通常有一段短的DNA序列,重复约20倍或更少。ALS和FTD患者中有数百甚至数千个这些重复,可产生二肽重复序列蛋白。在两种疾病的果蝇模型中,研究人员确定了两个含有精氨酸的蛋白质,尤其是它们是有毒的。当科学家们在果蝇的飞行系统中观察这些蛋白质时,组织退化是严重的。
Taylor说:“为无膜细胞器设计一种比精氨酸聚合物更有效的毒素,自然是很难的。”该小组继续系统地研究了人类细胞中所有蛋白质,以及与这些剧毒二肽重复蛋白质相互作用的其他小分子(相互作用组)。Taylor补充说:”我们的实验表明,有毒的含精氨酸肽可明显与RNA结合蛋白以及许多无膜细胞器的组件相互作用。”
在进一步的实验中,科学家发现,有毒的肽可改变含有低复杂度序列的区域的蛋白质相分离。本文共同作者、St. Jude儿童医院结构生物学系的Richard Kriwacki博士指出:“具有这些区域的蛋白质,属于一类固有的无序蛋白,构成了约三分之一的人类蛋白质组。因为它们的生物学意义和与疾病的关系,我们最近推出了一项合作研究联盟,更详细地了解这些蛋白质的生物学”。这个联盟——St. Jude儿童医院和普林斯顿大学、华盛顿大学之间的伙伴关系,将结合生物物理学和细胞生物学研究,来加快研究发生相分离相的固有无序蛋白。最终,这一工作将帮助科学家,通过改变这个关键的生物过程,为这种疾病开发新的治疗方法。
无膜细胞器依赖于相变所介导的组装,涉及蛋白质中低复杂度结构域的相互作用。Kriwacki说:“举一个例子,在目前的研究中,我们将核仁磷酸蛋白或NPM1确定为多肽毒素的靶标。”NPM1作为将细胞核中的蛋白质和RNA粘合在一起的“粘合剂”,细胞核是一种依赖于液相分离形成的无膜细胞器,是核糖体生物合成的场所。
这项研究的首席作者之一、St. Jude儿童医院的科学家Hong Joo Kim说:“我们的研究结果,将ALS和FTD中出现的有毒肽,与相变的复杂干扰以及众多无膜细胞器的功能障碍,联系在了一起。除了核仁之外,这包括破坏应激颗粒、核斑点、Cajal体等细胞器的损坏。”
关闭这些相互作用的循环,有助于研究人员更详细地了解神经系统疾病的机制,并帮助他们为未来的疾病研究和干预措施找到可能的靶标。
-
科技前沿
-
焦点事件