Science:人类蛋白酶体3D结构
恶性细胞不仅以比我们体内大多数健康细胞更快的速度增殖,它们还生成了更多的“垃圾”,例如错误和受损的蛋白质。这使得癌细胞天生更加依赖最重要的细胞垃圾处理设施——蛋白酶体来降解缺陷蛋白,从血液循环中清除掉它们。治疗某些类型的癌症,如多发性骨髓瘤就利用了这种依赖性。一些选择性阻断蛋白酶体的抑制剂被用来治疗患者。随后的细胞垃圾堆积会压倒癌细胞,最终杀死它。
来自德国哥根廷和汉堡的一个研究小组现在以前所未有的细节确定了人类蛋白酶体的3D结构,破译了抑制剂阻断蛋白酶体的确切机制。他们的惊人研究结果发布在《科学》(Science)杂志上,为开发出更有效的蛋白酶体抑制剂用于癌症治疗铺平了道路。
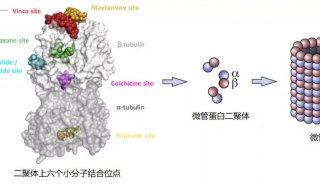
要了解诸如蛋白酶体一类细胞机器的运作机制,确定它的详细三维结构至关重要。拥有50.000多个原子,这一筒状蛋白酶体对于结构生物学家而言是一个真正的挑战。由马克斯普朗克生物物理化学研究所(MPI)的Ashwin Chari,和欧洲分子生物学实验室(EMBL)的Gleb Bourenkov领导的一个科学家小组,现在以1.8埃(Å)这一以前所未有的分辨率成功确定了人类蛋白酶体的三维结构——他们精确描绘出了每个原子在这一垃圾处理设施中的位置。
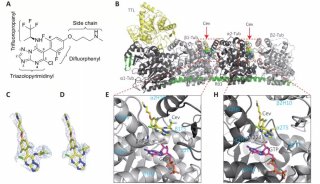
接下来,研究人员解开了与四种不同抑制剂(或已用于临床或当前正在进行临床试验)结合的蛋白酶体的结构。Chari说:“相比以往的蛋白酶体结构,显著提高的分辨率使得我们确立了这些抑制剂阻断蛋白酶体的确切化学机制。这一知识使得优化抑制剂的设计和疗效成为可能——因为只有为蛋白酶体量身定做的抑制剂才能完全关闭它。”
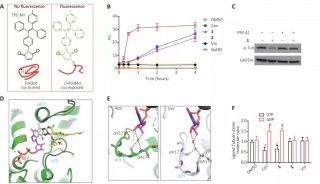
科学家们发现了有关蛋白酶体活性位点的一个重要细节。这一活性位点使得蛋白酶体能够降解细胞的垃圾,它是抑制剂药物结合来关闭蛋白酶体活性的位点。与普遍的看法相反,抑制剂和蛋白酶体活性位点的化学反应形成了一个7-环结构,其中包含了一个额外的亚甲基。研究人员解释说。这对于抑制剂的疗效和化学机制具有深远的影响。
欧洲分子生物学实验室的Thomas Schneider说:“尽管在蛋白酶体的50.000多个原子中,亚甲基只包含一个碳原子和两个伴随质子,它决定性地影响了使得抑制剂最有效阻断蛋白酶体的一些化学特征。”Holger Stark补充说:“当设计一些新抑制剂及寻找新候选药物时必须将之考虑进去。”
研究人员已为设计这样的抑制剂的一个化学程序提交了转录申请。