单分子荧光分析技术揭示解旋酶作用机制
类似解旋酶的蛋白与核酸相互位置的转变具有重要的细胞生物学意义,但是至今科学家们还并不清楚这个过程如何解开DNA结合蛋白,而且这一过程的基本特征迄今为止仍然倍受争议。 DNA修复指双链DNA上的损伤得到修复的现象,这个过程可能使DNA结构恢复原样,重新能执行它原来的功能,DNA修复是探索生命的一个重要方面,而且与遗传疾病、肿瘤学等密切相关。对不同的DNA损伤,细胞可以有不同的修复反应。
DNA解链酶在DNA不连续复制过程中,结合于复制叉前面,催化DNA双链结构解链,并具有ATP酶活性的酶,两种活性相互偶联,通过水解ATP提供解链的能量。不同来源的DNA解旋酶的共同特性是通过水解ATP提供解链的能量,而复制叉结构的存在与否对活性的影响因酶而异》
研究人员利用单分子荧光共振能量转移技术(FRET)解析了这一过程,这种PcrA螺旋酶通过2B位点结合在模板链上,沿着滞后链滑动,形成一个单链环,从而反复的,统一步骤的完成功能。这个过程需要PcrA开放性的结构,能快速的替换RecA,这为分析DNA复制过程提供了一种新模型。
这个过程使用了两种染料,这些染料荧光强度可根据它们之间的靠近距离发生改变。研究人员将两种染料分别连接到单链DNA的两个末端,从而能直接观察到DNA链的作用方式,他们发现这两种染料能相互靠近,然后又分开,这样重复,其中PcrA并没有沿着单链尾部移动,而是与DNA链断裂端结合,拉动DNA使之与结合蛋白分离。当这一过程结束的时候,PcrA就会松开。
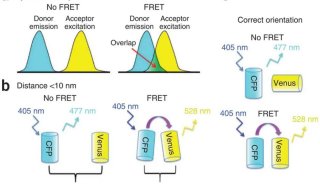
这里运用到的单分子荧光技术实际上就是大家熟悉的单分子荧光共振能量转移技术,这种技术是指当两种不同的荧光生色团离的较近,且其中一种生色团(供体, donor)的发射谱与另一种生色团(受体, acceptor)的激发谱有相当程度的重叠时,当供体被激发时,受体会因供体激发能的转移而被激发。其直观表现就是供体产生的荧光强度较其单独存在时要低的多,而受体发射的荧光却大大增强,同时伴随它们荧光寿命的相应缩短和延长。
这种技术是研究蛋白质相互作用比较成熟、已被广泛应用的几种方法之一,而用于DNA与蛋白之间的相互作用关系研究则是动态结构生物学研究领域关注的焦点。
用单分子荧光光谱技术研究生物分子构象变化的方法主要有两种:一是通过单分子荧光偏 振 的 各 向 异 性 ( single molecule fluorescencepolarization anisotropy,smFPA)研究生物分子的构象动力学(conformational dynamics)和旋转运动(rotational motions)。另一个是单分子对荧光共振能量转移(single pair fluorescence resonance energytransfer, spFRET),在单分子水平测量一个分子内或两个不同分子间的距离变化和相互作用。
在几年前,Taekjip Ha教授研究组就利用这一方法研究分析了DNA解旋酶,他们用荧光染料做上了标记:给Rep(DNA解旋酶中作为引擎的那部分结构)加上了绿色荧光蛋白,给DNA链末端加上了红色荧光蛋白,观测一个荧光分子如何传递能量给另一个从而获知被标记的分子相对于另一个被标记的分子是如何运动的。
研究人员发现当Rep靠近到DNA链末端阻隔时,这个酶并没有停在那儿而是跳回到了DNA链的开端重新开始,如果仍然“读”不过去,Rep就会重复这个过程。这也是Taekjip Ha教授利用FRET成功分析DNA复制过程的一个范例。
单分子FRET是对单个分子的荧光特性进行检测的过程,因为几乎所有的分子生物学实验结果只代表测量时间内大量分子的平均行为 ,而生物体系一般来说都是不均匀体系 ,尤其对于生物大分子而言 。因此监测单个生物大分子的行为具有重要意义。
FRET最基本的原理是通过易于检测的荧光共振能量转移的效率信息来反映两分子团的距离信息,而距离接近到 10 nm之间是两分子相互作用或一个分子的两个结构域因构象改变而相互靠近的有力证据。通过 FRET效率的增强可检测分子间发生相互作用或构象改变而靠近;FRET效率的减弱可用于证明两分子远离因而失去相互作用,或证明一个分子的两个部分间因分子被切断或构象改变而相互远离。
在分子水平上研究任何生物学机制都可以运用FRET技术,关键在于找到合适的荧光探针和检测设备。事实上FRET方法的应用领域非常广泛。在核蛋白机制、细胞外基质、生物膜功能、信号转导等多个方向领域都可以找到FRET技术的应用案例。这一技术无疑已成为细胞分子机制研究的重要工具。
-
焦点事件
-
项目成果