Mol Cell 相分离对于重新认识突触的形成与维持的重要意义
神经元(Neuron)是神经系统的基本功能单位,神经元之间的连接形成突触(Synapse),上一个神经元通过突触前膜(Pre-synapse)释放神经递质(Neurotransmitter),经过突触间隙(Synaptic cleft),被下一个神经元的突触后膜(Post-synapse)接收,实现神经元之间的信号传递。神经递质的释放受到突触前活性区(Presynaptic Active Zone)的精密控制。
早在半个世纪前,Couteaux【2】等就通过电镜观察到突触前存在一个蛋白质致密区。过去数十年的遗传学、生理学和生化学研究已经阐明了突触前活性区的分子组成,以及它们之间的相互作用机制【4】。但是这些纳米尺度的分子作用如何构建成电镜可见的复杂高维亚微米结构,并且能够在没有膜包被的情况下维持高浓度而不向胞质内扩散仍然困扰学界。从生物学功能角度,包裹神经递质的突触小泡(Synaptic Vesicle)对接(Docking)到活性区,在一组保守的分子复合物的帮助下活化(Priming),一旦动作电位(Action Potential)到来,突触前膜的去极化(Depolarization)将引起电压门控钙离子通道(Voltage-gated Calcium Channel, VGCC)的开放和钙离子的内流,进而促发突触小泡与突触前膜的融合(Fusion),实现神经递质的释放。从动作电位的到来到最终实现神经递质的释放,整个过程可以在几百微秒(μs)内完成【5】。近年来,越来越多实验证据和计算模拟表明,需要多个钙离子通道互相偶联在一起才能实现这种超快的神经递质释放【3】。但在分子机制上,并没有一个合适的模型可以解释这种偶联。
2019年1月17日,香港科技大学张明杰课题组在Molecular Cell杂志上发表了题为RIM and RIM-BP form presynaptic active zone-like condensates via phase separation的研究论文,该研究首次利用体外重组的方法探讨了以上两个问题,为突触前活性区的构建以及电压门控钙离子通道的偶联提供了一个可能机理。

本研究的主要发现点如下:
1. 重组表达的突触前活性区主要支架蛋白(Scaffold Protein)RIM和RIM-BP可发生液-液相分离(Liquid-Liquid Phase Separation)。结合Thomas Sudhof组之前的报导,RIM/RIM-BP双敲除可导致小鼠突触前活性区的蛋白质致密区缺失【1】,很可能支架蛋白的液-液相分离是构建突触前活性区的关键机制。

2. 通过对RIM/RIM-BP相分离驱动力的分析,在RIM上发现了新的RIM-BP结合位点。根据相分离理论,多价相互作用对相分离的引发至关重要,借助经典的分析相互作用的方法ITC,在RIM上发现了至少两个新的结合RIM-BP的位点。
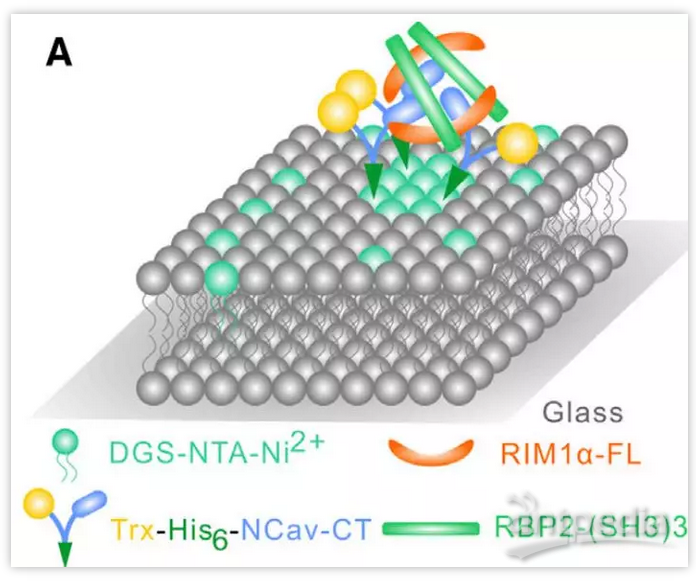
3. 中枢神经系统主要的电压门控钙离子通道(VGCC)N型的胞内段(NCav-CT),通过同时与RIM和RIM-BP相互作用,可以被富集进RIM/RIM-BP的浓缩相,并进一步促进相分离,为VGCC偶联进而实现神经递质超快速释放提供了一个可能的分子机制。在体外实验中,RIM/RIM-BP/VGCC相分离的阈值可以低至~1μM。考虑到体内更加多价的相互作用网络以及拥挤的胞质环境,体内类似的蛋白质浓度应当可以引起相分离的发生(下图)。

4. 体外重构了固定面支撑的磷脂双分子层(Supported Lipid Bilayer, SLB)(下图),VGCC可以在SLB 上自由扩散,而RIM/RIM-BP的注入会逐渐诱导VGCC的聚集(下图),模拟了在生物膜条件下的VGCC偶联。
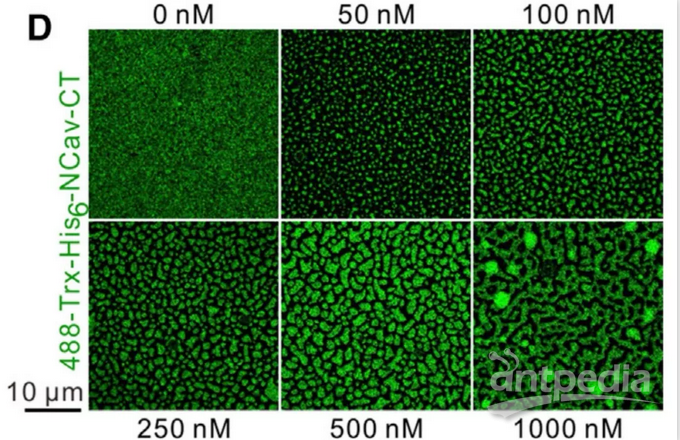
5. 首次在体外重构的膜系统中对膜蛋白(VGCC)的富集程度进行了定量估计与单分子追踪。通过对荧光强度的校准,直接估计了VGCC在浓缩相里的绝对密度,虽然VGCC团簇的大小和形状受到RIM/RIM-BP注入量的影响,VGCC的密度本身几乎维持不变,这一常量从生化角度提供了其聚集程度的极限。超分辨率显微成像直接展示了VGCC在SLB上的动态特征,其在浓缩相与稀疏相里显著不同的移动性体现了同一分子在不同相的不同特性,也间接体现了相分离的意义。
结合之前同一课题组对突触后致密区(Postsynaptic density, PSD)的体外重构(Cell丨张明杰组破解突触的建立与可塑性调节的机制)【6,7】,我们将重新认识突触的形成与维持。液-液相分离为突触前活性区和突触后致密区的构建提供了一种可能的机制。这种高度富集又高度动态的构建方式,既高度吻合了电镜观察结果与生理数据,又将进一步指导研究者通过调节相分离来理解突触可塑性,以及当它们失常时可能导致疾病的病理。
据悉,香港科技大学张明杰教授为本文的通讯作者,博士生吴先登和蔡期湑博士为共同第一作者。