显微操作技术在基因编辑中的应用(二)
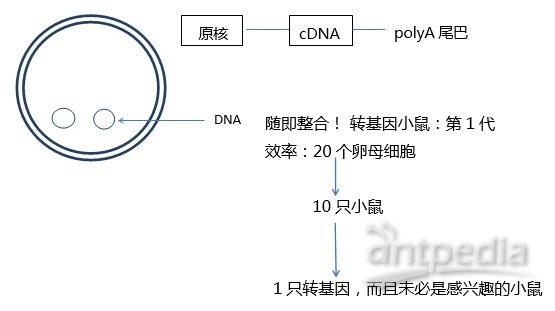
图6:PN 注射过程DNA 随机非靶向整合到基因组中
典型的PNI系统设置:
-DMi8:手动、电动部件可供选择
-透射光轴; S28聚光镜及微分干涉差
-5/10倍物镜(FLUOTAR或N PLAN)用于大致观察
-20倍、40倍长工作距离物镜。40倍物镜用于注射
-3板载物台(固定载物台的物体导杆妨碍显微操作器!)
-精选显微操作器(优选直接注入的毛细管:平角有助于尽可能降低胚胎受损程度)
-气压式手动显微注射仪用于固定(逆时针转动产生的负压可固定胚胎)
- FemtoJet®显微注射仪(少量液体,压力x 时间 = 体积)
-根据实验室偏好选择样品载体(玻璃底器皿、盖玻片等)
PN注射通常在室温下借助放大400倍的微分干涉差显微镜(一些还使用IMC)完成。(一些情况下还将胚胎冷却至10°C,使质膜更僵硬以方便注射)
胚胎干细胞移植
胚胎干细胞注入囊胚(图4),囊胚阶段从第3.5天开始,约128个细胞。内细胞群由多能性胚胎干细胞组成,也就是说它们可以发育并分化为不同类型细胞。有时注入八细胞阶段的桑椹胚胎 (图9)。
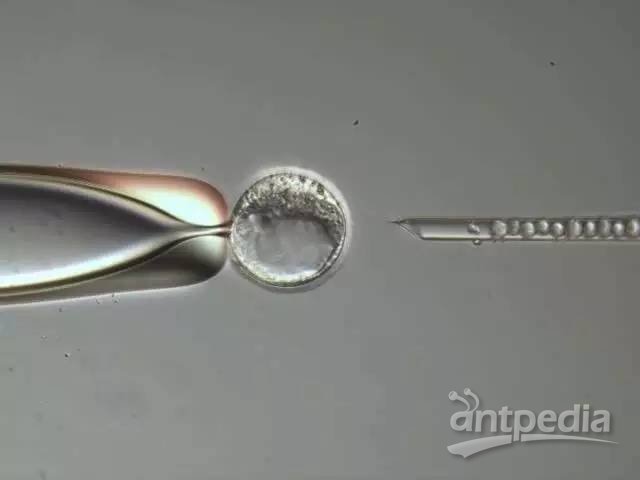
图7:ESI。以固定的毛细管(左侧)固定小鼠胚囊。经由毛细管将基因修饰的胚胎干细胞注入囊胚腔(右侧)。注射在内细胞群外滋养外胚层细胞之间完成。图片以徕卡AM6000上的徕卡DIC采集。
注入的胚胎干细胞与内细胞的胚胎干细胞发育为小鼠。这是一只嵌合体小鼠,其细胞/器官来源于注入的胚胎干细胞(雄性)和胚囊(雄性/雌性)。
目的基因的编辑在胚胎干细胞移植注射前完成,这耗时大约3-4个月 ,直至携带基因组DNA靶序列的ES细胞克隆被选定。大部分时间里修饰只出现在一个等位基因,意味着嵌合体是杂合的。产生的克隆在1个等位基因上携带靶突变(在两个等位基因上的概率非常低)。这项技术允许插入大约10-20 kB的DNA。靶向突变所用方法为同源重组。

图8:ES细胞DNA的靶向整合/突变
1)利用分子生物学技术创建含有靶DNA以及新霉素抗性位点、翻转酶识别位点(FTR)和CRE重组酶识别位点(loxP)的DNA。
2)通过转染方式将靶DNA注入ES细胞。重组体通过同源重组整合到基因组DNA。
3)往细胞培养物中添加新霉素(一种抗生素),以选择产生的ES克隆。只有具备新霉素抗性的克隆才能存活生长。挑出这些克隆继续培养。
4)添加翻转酶(一种切割DNA并将其重新结合的重组酶),消除新霉素抗性。
5)通过转基因小鼠与另外一只转基因“CRE小鼠”交配,loxP位点可以条件性敲除。表达CRE重组酶的小鼠通常具有类似组织特异性的表达,这种特异性的表达使小鼠具备例如在大脑中的基因的靶向敲除。
经由同源重组及ES细胞注射的靶向突变,多年来已成为“金标准”。与CRISPR相比,不足之处包括:
载体准备时间长
选择ES细胞克隆费时
载体克隆和ES细胞工作耗时约3个月
生成纯合子小鼠耗时约1年
如上所述,在大约 99% 的案例中,产生的嵌合体是杂合的。最终目的是获得用于研究的纯合子动物。
这是一个费时费力的交配、筛选过程:
1) 胚囊(♀或♂)+ ES细胞(♂)产生♂嵌合体。目的是获得生殖细胞中具有ES细胞修饰的嵌合体
2) ♂ 杂合嵌合体 + WT ♀产生杂合F1(♂或♀)
3) 杂合♂ + 杂合♀ 产生纯合F2代
纯合子小鼠的两个等位基因上均携带突变。最终获得这些有价值的动物耗时1年左右!
典型的ES移植系统设置:
-DMi8:手动、电动部件可供选择;
-透射光轴;S28聚光镜
-DIC为非必需。胚胎在胚囊阶段已经足够大,其细节容易观察。
- 5/10倍;20倍;40倍长工作距离物镜;较小NA = 较大景深
-3板载物台(固定载物台的物体导杆妨碍显微操作器!)
-精选显微操作器(优选直接注入的毛细管:平角有助于尽可能降低胚胎受损程度)
-气压式手动显微注射仪用于固定
-油压式或油压式带齿轮手动显微注射仪用于注射ES细胞。
ES细胞注射通常在室温下借助放大200倍的DIC/ IMC/PH显微镜完成。
ESI的差异在于将 ES细胞注入8细胞阶段的胚胎中(图9)。这项操作通常使用钝端毛细管完成,以免损伤细胞。激光器(Hamilton-Thorne,Octax或Piezo压电式破膜系统)可帮助钝端毛细管穿过透明带和膜。



























