新型冠状病毒如何入侵细胞及应对方法(二)
毒之所以难缠,关键就在于它们的进化极快,尤其是以单链RNA为遗传物质的病毒,由于没有DNA双螺旋的稳定性,其变异频率极高,。变异虽然大多有害,但是对于病毒这种复制速度极快的物种而言,只要有一种变异能够往适应环境的方向发展,那么这个变异的病毒就会迅速扩张壮大,令人防不胜防。
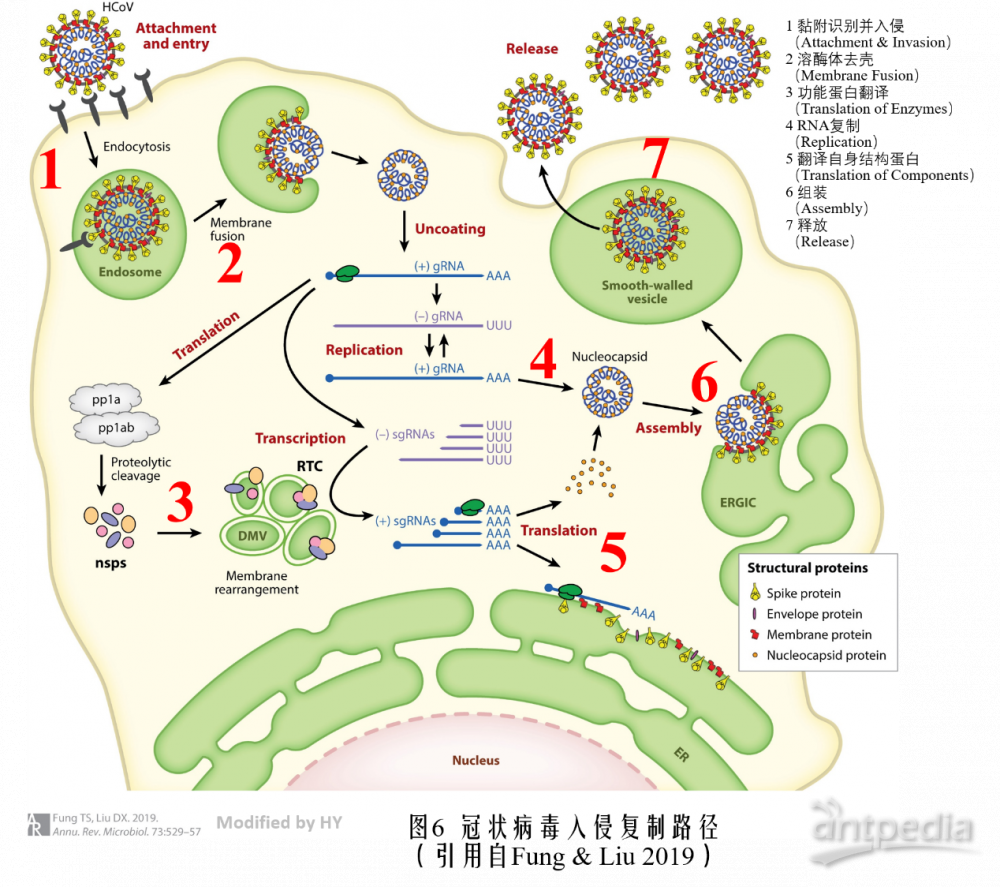
人类冠状病毒感染细胞分为7个步骤:(1)首先需要能和细胞接上头,这就要细胞表面的某个蛋白正好能和病毒表面的棘突结构相匹配,一旦匹配上,细胞便会用“保洁员”溶酶体将其“请进家门”;(2)接下来溶酶体便会按程序将其外部的脂膜和蛋白包膜溶解;(3)怎知这样正中病毒下怀,病毒正好借此将RNA释放进入细胞内,顺便利用细胞内部的翻译系统直接将自己的部分RNA转录成自己后续所需的酶;(4)在进行上一步的同时,病毒RNA也会不断利用细胞复制自己;(5)复制出来的病毒RNA会利用在第三步合成的酶在细胞的内质网上对自己的外部蛋白结构进行翻译;(6)经过上述一系列的操作,大量病毒的零件已经就位,于是组装成完整的病毒成品;(7)最后成品病毒所在的内质网与细胞膜的融合,把细胞内的病毒释放出去。释放的病毒再对其他细胞如法炮制。

目前关于2019-nCoV的感染机理研究才刚刚起步,不过由于其与其他冠状病毒结构上的类似性,其入侵过程应该与其他致病性人类冠状病毒相似。人们可以设计药物对这七个步骤进行干预,不论在哪一步阻断住病毒的进程,疾病便会得到控制。现行的抗病毒方法主要分为三类:血清/抗体疗法,疫苗疗法,化学药物疗法。
理论上说,目前有很多的痊愈患者,其自身在对抗病毒的过程中就产生了专杀2019-nCoV的抗体。那么是不是只要从他们血液中提取就行了呢?答案是否定的,血清成分复杂,危险性都很高,这是由于人产生的抗体是与自身的免疫系统相匹配的。如果强行用在其他人身上会引起排异反应造成危险;二来人类不是生物反应器,人类身体本身这种抗体存货就不多,抗体在应对过病毒后会减少,再加上提取过程中的损耗,完全不够使用;而单抗制作周期长,费用高昂,大面积用于现有病患不现实。
疫苗自不用说,天花就被我们用疫苗给干掉了,但一些善变的单链RNA病毒却没那么好对付,疫苗擅长应对相对“稳重”的DNA病毒,天花病毒就是这种太过“稳重”的DNA双链结构,难以快速发生变异而被人类消灭了。因为疫苗的原理就是注射抗原模拟病毒刺激体内免疫反应,一种疫苗只能模拟有同样抗原决定簇的病毒,如果因为突变导致这个结构不断变化,那么通过以前接种的疫苗产生的抗体或者记忆细胞将毫无用处。而且新疫苗开发周期长,无法应对目前的疫情。
所以,目前无论从时间还是现有的研究进度看,最有希望的就是药物疗法了。现在已经有了两种由吉利德公司开发的瑞德昔韦和氯喹,其中瑞德昔韦就是一种腺苷类似物,能够在病毒RNA复制的过程中整合到新链中导致RNA复制终止,抑制病毒增殖,有点类似于传统双脱氧末端终止法测序中用的双脱氧核苷酸,只不过瑞德昔韦针对的是RNA,而双脱氧核苷酸针对的是DNA。而氯喹则是一种已经广泛用于抗疟疾和自身免疫病的药物,已有体外实验表明氯喹主要在病毒进入细胞的过程中起阻碍作用。现在上述药物已经被特批进行临床实验,被寄予厚望。此外,武汉病毒所石正丽教授实验室还开发了一种广谱抗病毒肽段EK1,能够抑制包括SARS病毒和MERS病毒在内的5种冠状病毒进入细胞,而且实验是在人源化受体的小鼠中进行的,所以EK1也是潜在的药物。
针对药物开发,最好是药物能特异性识别病毒特有的结构,而对健康宿主细胞中的正常蛋白不要产生影响。但是在不影响大局的情况下,也可以对“自己人”下手,用药物削弱与病毒勾勾搭搭的自身蛋白,达到抑制病毒扩增的目的。目前已知的冠状病毒在入侵的7个步骤中都有相应的细胞作为内应为其服务,上面的表格就总结了武汉新冠状病毒爆发前所有能感染人的冠状病毒入侵宿主是宿主内的“内奸”蛋白,其中红框标注的是和强致病病毒相关的宿主蛋白。
在这些宿主蛋白中,与新冠状病毒相关的受体ACE2同时也是SARS病毒的受体,DPP4则介导MERS的侵入;Cathepsin L、Furin和TMPRSS11D负责切割S蛋白,帮助病毒进入细胞膜;GSK3在复制过程中对核蛋白磷酸化并协助病毒复制,hnRNPA1也在病毒RNA的合成过程中发挥作用;NL-GE对翻译好的病毒棘突蛋白和膜蛋白进行糖基化修饰;ER分子伴侣负责棘突蛋白的正确折叠。上述过程中的宿主蛋白可能是新冠状病毒药物研究的靶点。不过,在新冠状病毒的入侵机理弄清楚之前,其靶点只能参考亲缘关系较近的SARS病毒,不能完全生搬硬套SARS病毒的通路,而且这些蛋白本来也是人类正常生命活动所需,因而对于其感染的基础研究也是迫在眉睫。

自然界大多数病毒都是相当专一的,一般只特异性地感染少数物种,同时很多病毒也不会导致宿主发生生命危险,但是如果不同物种间接有频繁接触,就有可能导致宿主之间的病毒遗传物质发生交换,产生对新宿主的适应性或者更加剧烈的感染性,对新的宿主产生不可预料的影响。
从这次灾难中,我们不但应当吸取教训,在没有安全保障的情况下远离野生动物,减少未知病毒入侵人体的可能。也应该加大医药研究投入,尤其是基础研究的投入,随时为奋战在一线的医疗人员提供有力的武器和充足的后勤技术保障。目前除了被动应对已经爆发的病毒疫情,我们也应该着眼于将来对病毒的预防。
现在随着深度学习和人工智能的快速发展,如果能够利用这些技术手段,加上现有研究积累的大量病毒基因组数据以及突变数据,对病毒序列加以分析,对病毒变异有可能产生的宿主迁移进行概率预测,并对其棘突蛋白等关键结构的三维构象进行精准构建,提前进行药物设计,那么就会使我们面对病毒时更加主动,料敌于先,把病毒对人类造成的伤害降到最低,甚至将病毒疫情的爆发扼杀在摇篮之中。
参考文献:
1. To Sing Fung and Ding Xiang Liu. Human Coronavirus: Host-Pathogen Interaction. Annual Review of Microbiology. Vol. 73, (2019)
2. Zhou, P. et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature https://doi.org/10.1038/s41586-020-2012-7, (2020).
3. Wu, F. et al. A new coronavirus associated with human respiratory disease in China. Nature https://doi. org/10.1038/s41586-020-2008-3, (2020).
4. Jie Cui et al. Origin and evolution of pathogenic coronaviiruses. Nature reviews. (2019)
5. Shibo Jiang et at. An emerging coronavirus causing pneumonia outbreak in Wuhan, China: calling for developing therapeutic and prophylactic strategies. Emerging microbes&infections. (2020)
6. Chan et at. A familial cluster of pneumoniaassociated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster,The Lancet, (2020)
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件




















