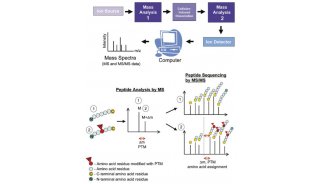
糖基化与免疫
蛋白糖基化是真核生物常见的蛋白质翻译后修饰过程,合成后的或正在合成的蛋白质在糖基转移酶的作用下,将活化的单糖加到肽链上。根据糖与肽链中氨基酸的连接方式不同,可将糖基化修饰分为三种形式:N-糖苷(N-glycan)、O-糖苷(O-gly-can)、糖基磷脂酰肌醇(glycosylphosphatidylinos-itol,GPI)。蛋白质经糖基化修饰后产生数千种具有独特生物活性糖蛋白,参与到机体生命活动的各个领域中。其中,蛋白糖基化与机体的免疫反应息息相关,如人类的ABO(H)血型系统就是由于人红细胞表面H抗原的糖基化方式不同而形成的,H抗原上添加GalNAc残基则转化成A抗原,添加半乳糖残基则转化成B抗原,而未经修饰的H抗原就是O型血红细胞表面抗原。几乎所有参与天然免疫和应答免疫中的免疫分子,如免疫球蛋白、细胞因子、补体、黏附分子和主要组织相容性复合物分子均属于糖蛋白。蛋白糖基化影响免疫分子的结构和功能,从而影响机体对抗原的应答反应。

糖基化与体液免疫
糖基化参与B细胞的活化过程
体液免疫是从B细胞的活化开始的。B细胞表面受体(BCR)识别抗原是B细胞活化的第一信号。BCR复合物由膜型Ig(mIg)与IgA/IgB组成。糖基化状况对BCR复合物的功能有重要的影响。BCR复合体中的mIg在B细胞膜上有严格的立体构象,这种构象若被破坏,就不能有效地识别接触和结合抗原。糖基化在维系mIg立体构象中起重要作用,糖基化程度低下,会使mIg肽链缺乏刚性;糖基化过度,会遮住mIg的抗原结合位点,影响与抗原的结合。CD22是B细胞抑制性辅助受体,对BCR复合物识别抗原产生的信号起抑制作用。CD22由B细胞本身表达,识别的配体是唾液酸聚糖分子,当自身反应性B细胞通过其BCR识别结合自身细胞表面的抗原后,其CD22识别结合自身细胞表面的唾液酸聚糖分子,使BCR和CD22发生交联,激活蛋白酪氨酸激酶,使CD22胞浆区免疫受体酪氨酸抑制基序(ITIM)中的酪氨酸磷酸化,从而抑制B细胞活化。而病原微生物细胞表面一般不表达这种唾液酸聚糖分子,可以刺激B细胞产生应答。因此,B细胞在激活过程中伴随着去唾液酸化以从CD22介导的抑制中释放BCR。
糖基化影响免疫球蛋白(Ig)的结构与功能
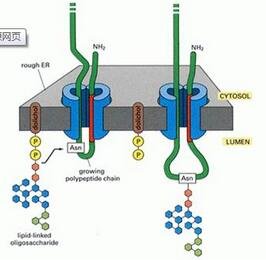
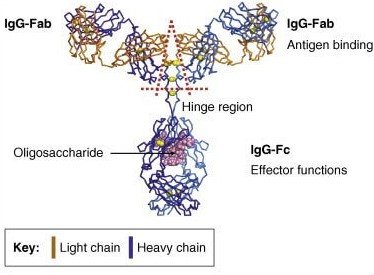
球蛋白合成过程中,其多肽链在内质网上开始加入糖基,随之转移至高尔基复合体,仍进行着部分糖基化修饰,最后成熟的免疫球蛋白在高尔基体的分泌囊泡内进行包装并转移至细胞膜上。高等脊椎动物体内免疫球蛋白的寡糖序列由分泌抗体的细胞糖基转移酶和糖苷酶水平决定。糖链一般连接在Ig的Fab、Fc及绞链区。在IgG,IgA,IgD中,连结Fab与Fc的绞链区由二硫键形成;而IgE,IgM的绞链区含有N-聚糖和O-聚糖,这使得它们的结构缺乏柔韧性。Ig轻链分子中糖含量为整个免疫球蛋白含量的2%~3%左右,而重链中糖含量相对较高,为12%~14%左右。
免疫球蛋白的聚糖功能众多,能维持免疫球蛋白的水溶性和特定构象,参与免疫识别与结合。IgA通过其N-聚糖结合病原物并介导清除,IgD的N-聚糖是合成、分泌必需的,IgD和IgA的O-聚糖则能保护则能保护扩展铰链区不被蛋白酶水解并能结合病原体,IgG的N-聚糖不仅辅助IgG维持四级结构和Fc的稳定性,也是Fc与Fc受体实现最佳结合所必需的。
经典的免疫球蛋白可根据其重链稳定区的不同及不同的二硫键化分为不同的种类,而近年来有人根据免疫球蛋白糖链功能的不同而将其化分为三种:G0型、G2型、S2型。G0型IgG的Fc糖链末端缺乏半乳糖,暴露N-乙酰葡萄糖残基(Glc-NAc);G2型IgGFc糖链末端有两个半乳糖残基(正常情况下IgG的主要糖型);S2型IgG的Fc糖链末端暴露有两个唾液酸残基。类风湿关节炎患者由于体内半乳糖转移酶对底物的亲和力低,G0型的IgG比例明显升高,其上暴露的N-乙酰葡萄糖残基与甘露聚糖结合凝集素相互作用,激活补体的级联反应,使补体攻击关节腔而产生类风湿。S2糖型IgG(以及末端有一个唾液酸残基的S1型IgG)的Fc受体亲和力低,具有抗炎性作用。最近的一项研究表明,IgG与Fc受体之间的相互作用取决于它们双方的糖结构。
Kaneko等在小鼠上做了一项试验,表明带有唾液酸残基的IgG与Fc受体的结合力降低。作者希望此种唾液酸化的IgG能用于由免疫炎性反应而引起的血小板减少症的治疗中。然而,由于人与小鼠IgG的种属差异,唾液酸化的IgG在人体内的作用还有待于进一步研究。
糖基化在补体凝集抗原中的作用
补体系统是主要的体液免疫效应机制之一,补体系统各组分均为糖蛋白。激活途径中的糖蛋白多数在肝脏细胞、巨噬细胞或淋巴细胞中合成,一般包含1~8个N-糖基化位点。这些聚糖在补体激活反应中起着很重要的作用,如C1q为六聚体,呈伞形,每一亚单位的球形头部都含有N-聚糖,它们维持着补体的空间构象,以提高C1q亚单位与效应物结合能力。再如B因子有四个内在的N-聚糖位点,它们参与调节B因子与C3b的相互作用。补体调节蛋白DAF和CD59可通过GPI锚结合在细胞膜上,DAF能降解C3/C5,CD59与C5b-8结合,阻止膜攻击复合物MAC形成,从而阻止补体对自身细胞的溶解作用等。
补体的活化过程中的甘露聚糖结合凝集素途径(mannan bindinglectin pathway)的活化过程无需抗体参与,主要通过血浆凝集素直接识别结合多种病原微-物表面大范围重复的糖结构(如甘露糖、岩藻糖及N-乙酰葡糖胺等),从而激活补体。在脊椎动物中,其细胞表面的上述糖结构均为其他成分所覆盖,故不能启动MBL途径。藉此,MBL途径得以识别自身细胞和非己病原微生物。