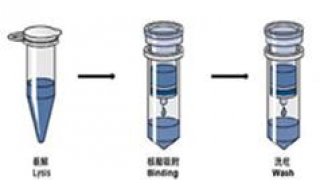
DNA斑点杂交方法(二)
核酸杂交法检测病原微生物
核酸杂交技术是根据两条互补的核苷酸单链可以杂交结合成双链的原理所建立,用一段已知序列的放射性或非放射性标记的核苷酸单链做探针,与待检标本中的DNA杂交来探查待检标本中有无与之相互补的核酸。该方法特异性高,但敏感性低于PCR方法。
本实验学习用非放射性标记物-地高辛(DIG)标记DNA片段作探针,用斑点杂交法检测病原微生物DNA的方法。
【原理】
用地高辛(DIG)类固醇半抗原标记特异DNA片段做探针,与待检标本中DNA杂交,然后加入碱性磷酸酶标记的抗-DIG抗体(抗DIG-AP),再加入碱性磷酸酶的作用底物(NBT/BCIP),若待检标本中有与探针同源的DNA序列,则探针与其杂交并与抗DIG-AP结合,碱性磷酸酶催化底物呈色,则在杂交膜上出现兰色斑点或条带。该探针可用于斑点杂交,菌落原位杂交及Southern blot杂交。
(一)DIG-DNA探针的制备(随机引物法标记)
【材料】
1. 待标记DNA (0.5~3ug)
2. 六核苷酸混合物 ( hexanucleotide mix)
3. dNTP标记混合物,Klenow enzyme
4. 其它试剂4M LiCl,无水乙醇,TE溶液(10mMTris-HCl,lmM EDTA PH8.0);0.2M EDTA pH8.0
【方法】
1. 取待标记DNA(0.5~3ug),加无菌去离子水至终体积15ul,于沸水浴变性10分钟后迅速置冰/氯化钠中冷却。
2. 在冰/氯化钠上添加:
2ul 六核苷酸混合物( hexanucleotide mix)
2ul dNTP mix
1ul Klenow enzyme
3. 混匀并短暂离心,然后于37℃孵育至少60分钟。
4. 加入2ul 0.2M EDTA,pH8.0以中止反应。
5. 加入2.5ul 4M LiCl及75ul经-20℃预冷的无水乙醇,充分混匀, -70℃放置30分钟或-20℃放置2h。
6. 12000rpm/min离心15min,用50ul预冷的70%乙醇洗涤沉淀物。
7. 真空短暂干燥,用50ulTE溶液溶解沉淀。
【说明】
DIG标记的DNA片断大小为200~1000bp。每次标准标记反应模板DNA量为0.5~3ug,如标记大量DNA需相应增加反应物和反应体积。若延长37℃孵育时间(到20h)可增加DIG标记产物量。
(二)斑点杂交法
【材料】
1. 硝酸纤维素膜,待检标本DNA
2. 标准预杂交液(5× SSC;0.1%月桂酸;0.02%SDS;1/10体积的10倍浓缩阻断液(含变性并剪切的鲑精DNA)。
3. 洗液1(2×SSC,0.1%SDS); 洗液2 (0.1×SSC,0.1 %SDS)。
【方法】
1. 杂交膜的制备
①将从待检标本提取的核酸(质粒或 染色体DNA)100℃ 10 min 煮沸变性,迅速置冰/氯化钠中冷却。
②膜的处理:用2×SSC ,湿润均匀,37℃烘干后,即可点样
③点样:取变性待检核酸1ul 点在硝酸纤维素膜(0.45um)上,同 时设阳性和阴性对照,室温干燥。
④80℃真空干燥2h,将DNA固定于膜上。
2. 预杂交及杂交
①预杂交:将杂交膜放入装有适当体积预热的标准预杂交液的杂交 袋或杂交杯中 ,37℃预杂交 30分钟,轻轻搅拌使膜在该温度下孵育。
②将DIG标记的DNA探针置沸水浴5min后,迅速用冰水冷却以变 性DNA探针。
③将变性的DIG标记DNA探针加入到预热的标准预杂交液(2.5ml/ cm2)中并充分混匀。
④将杂交膜放到含DIG标记探针的杂交液中。轻轻搅拌,在68℃ 孵育至少6h(对于检测微量DNA中的单拷贝基因则需孵育16h)。
⑤杂交后洗涤:用足够量的2×SSC,0.1%SDS室温漂洗2次,每次5min;用0.1×SSC,0.1%SDS 68℃漂洗2次,每次15min,漂洗过程中需不断轻轻搅拌。
(三)免疫学检测
【材料】
1. 马来酸缓冲液(0.1M马来酸,0.15M Nacl。pH7.5)
2. 洗液(马来酸缓冲液加入0.3%吐温20(v/v))
3. 阻断液(10×浓缩的阻断液经马来酸缓冲液10倍稀释,新鲜配制)
4. 检测液(lM Tri s-HCl,0.1MNaCl,50mM Mgcl2,pH9.5(20℃预热)
5. 显色基底液(加200ul NBT/BCIP浓缩液到10ml检测液中,新鲜配制)
【方法】
1. 将经过杂交和严格清洗后的膜用马来酸缓冲液漂洗1~5min;将膜在l00ul阻断液中孵育30min。
2. 用阻断液稀释抗D1G抗体至适宜浓度(1:5000左右)。
3. 倾出封闭液,将膜在20ml抗DIG抗体溶液中孵育膜30min;马来酸缓冲液洗膜2次,每次15min,再用2m1检测液平衡膜2~5min。
4. 将杂交膜在现配制的显色基底液中孵育,并用塑料袋或盒在暗室中密闭保存(显色过程中不能摇动)。
5. 几分钟内可有颜色沉淀形成(16h完成反应,反应过程中可短暂暴露于阳光下以观察反应进展)。
6. 当颜色斑点(或条带)达到一定强度后,可用50ml去离子水或TE溶液洗膜5min以中止反应。
7. 显色后的滤膜可封存于聚乙烯袋内或拍照片保存。