新药开发的8个步骤

新药从研发到上市的过程中需进行的工作概括:
药物临床前研究(药物的合成工艺、提取方法、理化性质、纯度、剂型选择、处方筛选、制备工艺、检验方法、质量指标、稳定性、药理、毒理、动物药代动力学研究等)
申请获得临床试验批件
进行临床试验(包括生物等效性试验)研究
新药申请
获得新药证书和药品批准文号
进行药品生产
上市后监测

下面我们来看一下罗氏新药研发的8个步骤:
1.无数的分子结构:分子无限,但是极少数可以成为药品
在世界上,可能存在的分子结构数量巨大——比宇宙大爆炸以来流逝的时间秒数还要多。据估计,它们的数量在10的60次方左右。
而实际上,在这些可能存在的分子结构中,有很多是根本不存在的。罗氏研究人员利用他们的专业知识和先进的科学工具,在实验室里把已知的元素结合到一起,创造出数以千计的新合成化合物。
然后,他们对这些化合物进行筛选,找出其中可以开发药物的。
从这个过程开始到最后医生开处方,大概需要12年时间。
2.寻找最好的化合物:大海捞针
在分子水平上对疾病病因的新见解是开始创新战略研究的出发点,这引领了具有选择性作用的新药的产生。
一旦靶标被确认,研究人员即设计出开发方案,显示出候选药物是怎样影响着特定的生理结构或生理特性。
然后研究者对这些候选药物通过进一步化验或计算机程序进行评估。在这一过程中,候选药物会经常被修改。
3.开发新疗法:进步需要研究
我们需要开发新疗法,测试新化合物的疗效。我们希望治愈严重疾病——至少能够缓解症状。我们希望拯救生命。
为达到这些目标,动物实验是必不可少的,即使是在21世纪。毕竟,许多调查只能在动物身上进行。
例如,通常来说,只有动物实验能够揭示实验药物难以分辨的危险的副作用。换句话说,动物实验为患者的安全提供了保障。
医学研究尊重所有的生物——包括在实验中使用的。
罗氏负责任地处理每一个委托给它的生物,它只利用动物测试有前途的候选药物。
不必要的痛苦和疼痛被避免,所有的实验都需要经过授权,最高的道德标准也适用于动物实验。
同国家和国际准则一样,罗氏已经对自身、雇员、合作研究公司施加了极高的自愿性标准,也尽可能选择其他方法替代动物实验。罗氏一直在不断改进。
4.临床试验
一旦候选药物通过初步测试后,它们真正的挑战就开始了。它们必须在临床试验中表明,它们是有效的,并且耐受性良好。
临床试验要经过4个阶段。只有当候选药物成功通过前一个阶段,才可以进入下一阶段。
第一阶段:耐受性和安全性
候选药物首先在健康志愿者身上进行安全性和耐受性测试。这些研究配备有专门的医疗设施,确保参与者得到最好的照顾。
研究人员可以看到新药在人体内的活动,获得关于药物影响和最适当剂量的初步信息。
第二阶段:临床疗效观察
下一个步骤是确定药物的作用机制,也就是证明它是有效的。
研究人员与经过仔细分组的患者一起工作,让他们接受一定范围的用药量。这用来确定理想的剂量。
参加第二阶段研究的患者由医师调查人员照顾,他们被密切监测,以期尽早识别潜在的风险。
第三阶段:记录治疗结果
只有到现在,开发者才在类似于临床给药的情况下开展涉及到5000人的大规模试验。
这提供了一个药物在临床试验中是如何使用的逼真的画面。这一阶段获得的信息也对在时机成熟时开展药物营销非常重要。
第四阶段:持续监测
甚至在被审批后,药物仍然在专家的监测下。在服药的患者身上观察到的所有副作用都必须被记录下来,并在说明书上列出。
5.临床试验分析:改良如山的数据
临床实验会产生大量需要仔细处理和分析的原始数据。这些结果然后被提交给医学会议,并在医学杂志上发表。
临床试验遵循着一个明确的计划或设计,每一个子研究都用于回答一个重要的问题。仔细的数据处理和分析是必须的。
研究人员依靠久经考验的统计方法分析数据。在实验开始之前,这些都要到监管当局指定申请。这样在任何时刻,数据都可以接受监视和检查。
在参与实验的中心,大量的数据直接在网上输入、电子处理,提交给当局。
第三期临床实验在相关疾病领域的专家的指导下进行,这些专家利益独立。当实验结果提交给医学会议或医学杂志上时,他们也会出现,即使试验失败,药物未能产生预期的治疗反应。
此外,罗氏会定期在www.rochetrials.com上更新自己的临床实验。
6.推出前官方确认
每个国家的药物在进入市场之前都需要通过监管机构的审批。
监管机构的任务
每个国家都有专门的监管机构检查和监控医药产品的安全性和有效性。在瑞士,它是Swissmedic,欧盟国家是EMEA,美国是FDA——可能是世界上最知名的药物监管机构。大多数监管部门也检查在其管辖范围内批准营销的所有药品的生产工厂。
监管审查
当一种新药报批时,监管机构需要全面的文档。这通常需要数百个文件,其中许多必须提交多个副本。
当局完成审查可能需要几个月到几年时间。
在这段时间内药物制造商和当局会定期互相联系。如果监管机构对此事态度积极则意味着该药物有可能在其管辖范围内销售。
包装说明书——新药的简略描述
包装说明书是药物所有数据的汇总。它描述了药物被批准的适应症、复用方式、可能发生的副作用。
包装说明书提供了新药的简略描述,能让广大市民轻松理解。
7.大规模的药品生产
在研究和开发过程中少量的药物就足够,但是在临床实践中需要大量的药物。
扩大新药的生产始终是一个挑战,需要保证高质量和高精度。罗氏在这一块有几十年的经验可以借鉴。
8.医药产品
制造商把药物制成药丸、胶囊、安培瓶或预充式注射器,将其打包,然后将它连同包装一起放在纸箱里,运送到药店——全部符合国家规定。
从研究者最开始发现分子到现在,需要经过多个步骤,超过12年时间。
现在你的医生可以随时根据你的需要把这个药开给你。
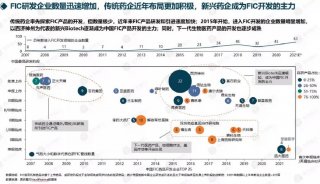
我国在创新药物研发的征途上任重道远,可也蓄势喷薄。正如华尔街日报前段时间发表的《China Emerges as Powerhouse for Biotech Drugs》中表述的观点:中国正在成为国际生物技术药物发展的中坚力量。根据美国国立卫生研究院的数据显示,我国已经是世界上开展临床试验数量第二多的国家。
国家政策支持和资本投入助力创新药研发。“十三五”期间,国家在重大新药专项实施思路上力求“变”,这在新药专项投入上可见一斑。中国工程院院士、中国药学会理事长桑国卫透露,概算至2020年,我国在新药专项上的总投入将达到260亿人民币。
近年来,我国医药研发增速已经跃升全球第一,创新产出和能力快速提高。国内涌现的一批批医药创新研发实力派企业是最好的例证。这些企业超强的研发实力和独特的商业模式真正诠释了国内新药研发企业向创新型转变,走向世界舞台是大势所趋。