血红蛋白与核黄素的凝胶柱色谱分离
原理
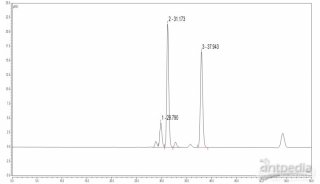
凝胶渗透色谱就是按照溶质分子的大小不同而进行分离的一种色谱技术,当溶质分子大小不同的样品溶液通过凝胶柱时,由于凝胶颗粒内部的网络结构具有分子筛作用,分子大小不同的溶质就会受到不同的阻滞作用,本实验血红蛋白分子量大,不易渗入网络,被排阻在凝胶颗粒之外,因而所受到阻滞作用小,先流出色谱床。核黄素分子量小,能渗透到网络的内部,洗脱流程长,因此所受到的阻滞作用大,后流出色谱床,这样就可以达到分级分离的目的。
本实验采用Sephadex G-25凝胶柱,分离血红蛋白和核黄素的混合溶液,并测出洗脱曲线。
操作
1.凝胶处理:
(1)溶涨与浮选:将凝胶放入过量的水中浸泡6小时(沸水浴中为2小时)。浸泡后搅动凝胶再静置,待凝胶沉积后,倾去上层细粒悬液,如此反复多次。
(2)平衡:将浸泡后的凝胶,用十倍量的洗脱液处理,约1小时,搅拌后继续去除上层细浮悬液。
2.装柱
将色谱柱垂装好,自柱底端出口的胶皮管内用重力通入溶液以除去柱管内和砂芯底部的气泡,待气泡排出后,使溶液在底端留至3~5cm高即行关闭,将处理好的凝胶在烧杯内用2倍的溶液搅调成悬浮液,自柱顶部沿管内壁缓缓加入柱中,待底部凝胶沉积至1~2cm时,打开底端出口管,随之继续添加凝胶悬液直至床体积沉积至25cm高度为止。(操作中注意防止产生气泡与节痕)。
3.平衡:柱装好后,使色谱床稳定5~10分钟,然后接上恒流泵,打开出口用2倍于床体积的洗脱液平衡,使色谱床稳定。流速为0.5ml/分。
注意:在洗脱时,要将恒流泵至色谱柱的连接管内气泡全部排除,以免影响流速,调节流速可在靠近柱的底部加一调节阀,另外在调节中务必防止流速过大以及色谱床液体流干。此外如果需要温度平衡则同时在色谱柱夹套内通入恒温冷却水。
4.色谱床校正:为了取得良好的色谱效果,因此在色谱前需要对所装的色谱柱进行检查,检查的方法如下:
首先用肉眼观察色谱床是否均匀,有没有“纹路”和气泡,床表面是不平整,然后再用兰葡聚糖2000进行色谱行为的检查,在色谱柱内加入1ml(2mg/ml)兰葡聚糖2000,然后用洗脱液进行洗脱(流速同前),在色谱中当移动的指示剂色带狭窄,均一,则说明装柱良好,检查后再经洗脱平衡再重复步骤“3”即可使用。
5.加样与洗脱:打开平衡好的色谱柱底部出口,使柱内溶液流至床表面时关闭,将吸有0.5ml样品的加样滴管在床表面上1mm处沿管内壁轻轻转动加进样品,加完后,再打开底端出口使样品流至床表面。用少量洗脱液同样小心清洗表面1~2次,然后将洗脱液在柱内约加至2cm高,接上恒流泵并调好流速即开始洗脱(注意在加样和洗脱过程中防止冲坏床表面)。
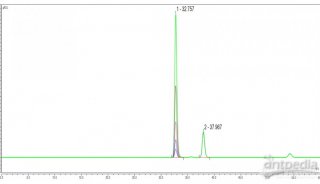
6.收集与测定:收集时可用自动分部收集器,每管接洗脱液3ml,或以手工操作分管收集15管,收集后用72型(或721型)分光光度计在451nm波长处以脱液为空白,对每管收集液进行光吸收测定,测定后以收集管数(或ml)为横坐标,吸光度为纵坐标对应作图。
[注]:市售凝胶如需彻底处理,可在溶涨后再用0.5N NaOH-0.5N NaCl溶液在室温中浸泡半小时,但注意必须避免在酸或碱中加热。另外,用过的凝胶柱如需再生时,可用0.1N
NaOH-0.5N NaCl,洗涤以去掉堵住凝胶孔的杂质,然后用蒸馏水洗至中性备用。一般使用
几次后就需要再生。
仪器
1.色谱柱:高40cm,内径10mm
2.恒流泵
3.自动分部收集器
4.刻度吸管、试管
5.722型分光光度计
试剂
1.葡聚糖凝胶,Sephadex G-25
2.血红蛋白及核黄素
3.洗脱液:0.05mol/L pH7.3磷酸缓冲液