Cell子刊:西湖大学研发广谱肽 可有效抑制多种新冠病毒变体
COVID-19大流行已导致超过600万人丧生。尽管已有许多疫苗和治疗方法获得批准,并且可以有效减轻严重急性呼吸综合征冠状病毒2(SARS-CoV-2)感染引起的症状,但是不同的SARS-CoV-2变体,尤其是Omicron变体,已被证明可以广泛逃避免疫反应。目前,一些针对新冠病毒主蛋白酶的小分子药物显示出对突变株具有良好的耐受性。然而,不同的耐药毒株不断出现,而小分子药物的广泛使用也可能进一步加速耐药毒株的出现。
与其他冠状病毒类似,SARS-CoV-2的感染需要病毒包膜与细胞膜之间的融合,这个过程是由病毒刺突蛋白(S蛋白)介导的。SARS-CoV-2的S蛋白由S1和S2两个亚基组成,S1亚基通过受体结合域(RBD)与细胞受体血管紧张素转化酶2(ACE2)结合,触发S2亚基发生构象变化,从而在HR1和HR2两个结构域之间形成六螺旋结构(6-HB),驱动靶细胞和病毒膜融合。由于HR1和HR2这两个结构域在不同冠状病毒中非常保守,因此,来源于这两个结构域的多肽被认为是有前景的抗病毒药物。
近期,西湖大学的党波波研究团队在在《Cell Reports Medicine》杂志上发表了一篇题为“An enhanced broad-spectrum peptide inhibits Omicron variants in vivo”的文章,该研究开发了一种广谱SARS-CoV-2融合抑制剂,命名为A1L35HR2m-Chol。该抑制剂能够在体外和体内广泛有效地抑制冠状病毒,并对当前和新出现的SARS-CoV-2变种表现出强大的功效。这一研究结果为控制冠状病毒的传播提供了重要的突破,对于应对COVID-19大流行和未来的冠状病毒变种具有重要意义。

来源:https://doi.org/10.1016/j.xcrm.2024.101418
有研究表明,将靶向SARS-CoV-2病毒刺突蛋白不同位点的配体结合起来可能会产生协同的抑制效果。党波波研究团队推测来源于ACE2的多肽与RBD结构域结合后可能会破坏病毒刺突蛋白的稳定性,最终导致HR1结构域的暴露。随后,来源于HR2的肽可能会与病毒HR1结构域结合,从而抑制病毒。
团队研究人员首先通过相对较长的柔性接头(GGGGS)7将ACE2衍生的肽A1引入到HR2m肽的N端,生成A1-(GGGGS)7-HR2m (A1L35HR2m)。研究人员还通过交换 A1 肽和 HR2m 肽 (HR2mL35A1) 的位置或通过缩短接头长度来构建其他三种融合肽,以生成 A1L5HR2m 和 A1HR2m。所有四种融合肽均通过重组表达制备,并使用 SDS-PAGE 和液相色谱-质谱法对所得肽的纯度进行了表征。
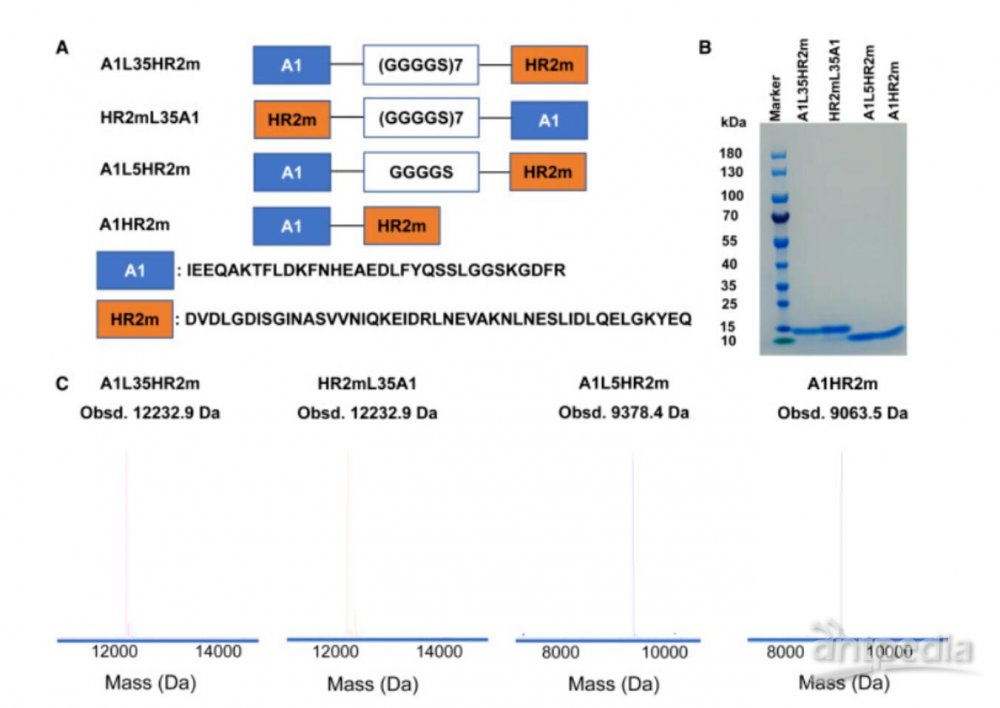
图:A1L35HR2m、HR2mL35A1、A1L5HR2m 和 A1HR2m 的设计和特性
研究人员使用 SARS-CoV-2 假型病毒感染测定评估了 A1L35HR2m、HR2mL35A1、A1L5HR2m 和 A1LHR2m 的抑制活性。结果发现,在具有长柔性接头的 HR2m 肽的 N 末端添加 ACE2 衍生肽 A1 可以显著提高抗 SARS-CoV-2 活性。研究人员采用 S 蛋白介导的细胞-细胞融合测定探索 A1L35HR2m 病毒抑制机制,结果发现 A1L35HR2m 有效抑制 SARS-CoV-2 D614G S 蛋白介导的 293T/EGFP/S 和 Caco-2 细胞之间的细胞融合,这些结果表明,A1L35HR2m 增强的抗 SARS-CoV-2 活性可能是由于其抑制 SARS-CoV-2 与靶细胞融合的能力提高。
先前的研究表明,脂质HIV-1融合抑制剂可以增强离体抗HIV-1活性并提高体内稳定性。研究人员接下来探索了 A1L35HR2m-Chol 是否也表现出增强的离体抗 SARS-CoV-2 活性和延长的体内半衰期。
研究团队使用已建立的K18-hACE2转基因小鼠模型评估了A1L35HR2m-Chol的预防和治疗效果。在预防性研究中,研究团队发现相比于对照组的小鼠,接受A1L35HR2m-Chol治疗的小鼠的肺组织匀浆中的病毒RNA拷贝数量明显减少,鼻甲中的病毒RNA拷贝数量也明显减少。此外,在A1L35HR2m-Chol治疗的小鼠中,可传染性病毒滴度显著低于对照组。
值得注意的是,接受A1L35HR2m-Chol治疗的小鼠鼻甲中几乎没有可传染性病毒滴度,这表明A1L35HR2m-Chol具有抑制病毒传播的潜力。在治疗性研究中,相比于对照组,接受A1L35HR2m-Chol治疗的小鼠鼻甲中的病毒RNA拷贝数显著减少,而肺组织匀浆中的病毒RNA拷贝数两组之间没有显著差异。更重要的是,A1L35HR2m-Chol完全抑制了肺组织匀浆中的可传染性病毒滴度,并没有检测到活的SARS-CoV-2病毒颗粒。A1L35HR2m-Chol在预防和治疗模式下对SARS-CoV-2 Omicron BA.5感染均表现出强效的保护作用。
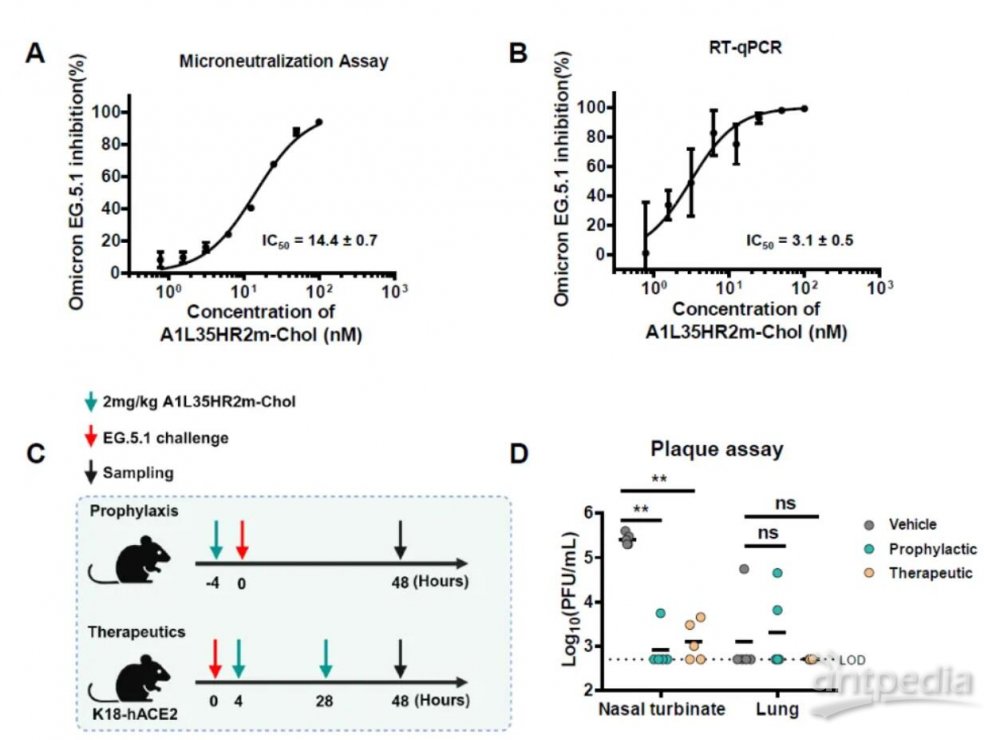
图. A1L35HR2m-Chol在体外和体内有效抑制Omicron EG.5.1突变株
在研究过程中,Omicron EG.5.1 成为了 SARS-CoV-2 的主要流行毒株。作者评估了 A1L35HR2m-Chol 针对 Omicron EG.5.1 的抗病毒功效。研究人员首先使用 VeroE6-TMPRSS2 细胞进行微量中和病毒载量测定。结果显示,A1L35HR2m-Chol 可显著抑制 EG.5.1 复制。总之,A1L35HR2m-Chol 可以在体外和体内有效抑制新出现的占主导地位的 EG.5.1 变体。
随着SARS-CoV-2在全球继续传播,新的变种仍在迅速出现,对当前疫苗和治疗方法提出了巨大挑战。病毒与宿主细胞之间的膜融合机制在不同的冠状病毒中非常保守,HR1和HR2结构域之间的六螺旋捆绑在驱动膜融合中起着关键作用。
在这项研究中,党波波研究团队成功地开发了一种能够显著提高HR2肽病毒抑制活性的方法。通过工程化的A1L35HR2m-Chol,成功地抑制了不同的SARS-CoV-2 VOC、SARS-CoV和MERS-CoV。这一发现表明A1L35HR2m-Chol是一种具有潜力的抗病毒分子,可以在体外和体内广泛有效地抑制冠状病毒。此外,研究团队相信A1L35HR2m-Chol还能保持对未来出现的SARS-CoV-2变异体的抑制活性。这些发现为进一步的转化研究提供了有力的依据。
-
企业风采

-
项目成果

-
焦点事件

-
项目成果