FAO通路通过抑制失巢凋亡促进结肠直肠癌细胞远端转移
中山大学附属肿瘤医院肿瘤研究所徐瑞华教授长期从事消化道肿瘤个体化治疗及抗癌药物研究。该课题组利用NuRNA™ Human Central Metabolism PCR Array研究发现在非贴壁的结直肠癌细胞中,脂肪酸氧化(FAO)通路被激活。而在转移的肿瘤中,CPT1A表达上调,由CPT1A介导的FAO通路激活,通过调控氧化还原稳态抑制其失巢凋亡,促进非粘附的CRC细胞增殖存活。该研究成果发表在学术期刊Oncogene(IF:6.854)。
研究背景
结直肠癌(CRC)是最常见的肠胃肿瘤,由于其容易发生远端转移,使之成为肿瘤相关死亡的主要原因。远端转移是一个复杂的过程,具有侵袭性的癌细胞从原发肿瘤中脱离,进入血液和淋巴管,只有其中一些细胞可以从血管渗出,并定居在新的器官,形成远端转移。转移过程中大部分细胞,由于脱离原发灶,失去与胞外基质的粘附,导致细胞失巢凋亡。
FAO也称为β-氧化,是脂肪酸分解产生乙酰辅酶A的过程,同时生成ATP,NADPH,MADH和FADH2。肉毒碱棕榈酰转移酶1A(CPT1A)定位在线粒体膜上,是FAO中最主要的限速酶。已有文章报道,CPT1A与多种肿瘤进程相关。考虑到FAO参与了非粘附肿瘤细胞的代谢过程,作者猜测CPT1A在肿瘤细胞能量代谢调节和转移抑制中会是好的靶标。
研究思路:
该研究着重于CPT1A介导的FAO通路激活,通过维持氧化还原稳态,保护结直肠癌细胞免受失巢凋亡的影响。作者运用NuRNA™ Human Central Metabolism PCR Array分析了超低粘附生长的及正常贴壁生长的HCT15和HCT116两种细胞中代谢相关基因的表达。基因富集分析结果显示,两种细胞中FAO通路被明显激活。由于CPT1A是FAO通路的关键基因,作者因此集中于研究CPT1A在CRC转移中的作用。qRT-PCR结果显示,在悬浮的CRC细胞中,FAO通路中的关键基因明显上调。其后作者分析了临床病人中原位肿瘤和转移灶的样本,发现CPT1A在转移灶中表达上调。
为了进一步研究CPT1A在非粘附CRC细胞中的功能,作者建立了CPT1A敲低的稳定株,发现在细胞非粘附生长时,敲低CPT1A可明显抑制了细胞成活与克隆形成,也可以检测到细胞失巢凋亡明显升高。在培养基中添加油酸盐,可以促进CRC细胞克隆形成,此过程可以被etomoxir抑制,意味着CPT1A介导的FAO激活促进非粘附的CRC细胞增殖存活。
CPT1A敲低的CRC细胞中,无法维持NADPH/NADP+和GSH/GSSG的平衡,导致很高的活性氧水平。所以CTP1A诱导的FAO通过促进活性氧清除是抑制失巢凋亡的主要因素。在体内实验中,敲低CPT1A可以减少CRC细胞的肝转移和肺转移,用etomoxir则可抑制CRC的肝转移和肺转移,预示着用etomoxir靶向CPT1A可以有效地激活失巢凋亡并减少CRC细胞转移。
技术路线:
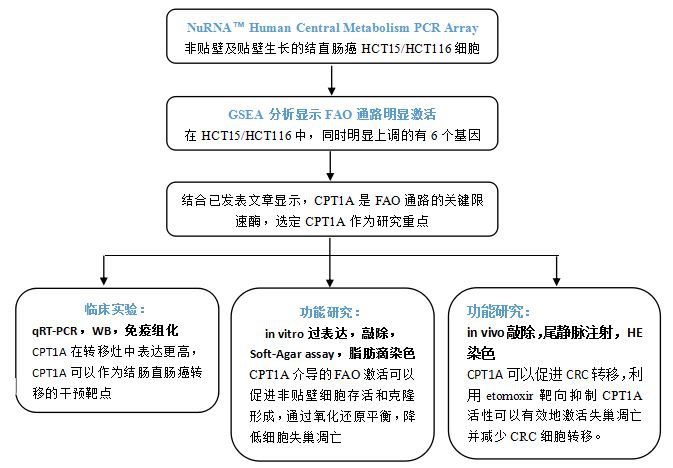
结果展示:
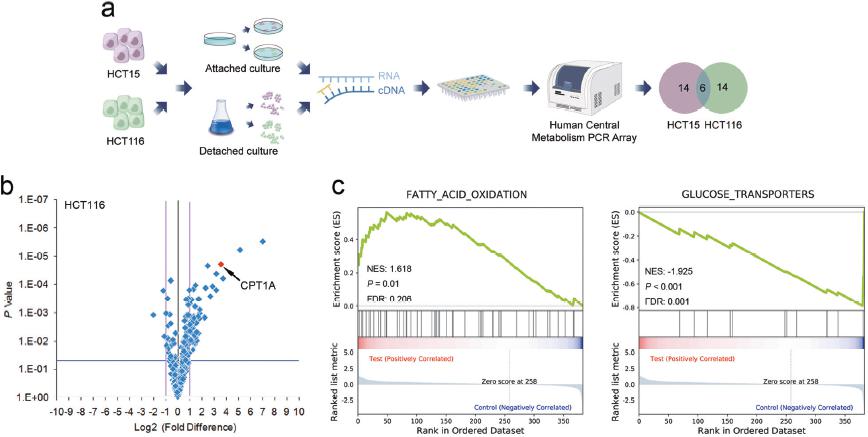
图1:a实验流程;b\c NuRNA™ Human Central Metabolism PCR Array分析代谢相关基因转录变化的火山图和基因富集分析;
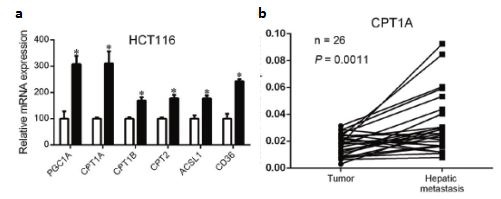
图2: a qPCR验证FAO通路相关基因在非粘附的HCT116中高表达,FAO通路被激活;b CPT1A在转移灶中表达上调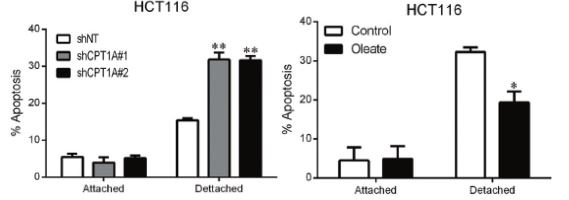
图3:非粘附HCT116细胞中敲除CPT1A或在培养基中加入油酸盐,可以促进细胞失巢凋亡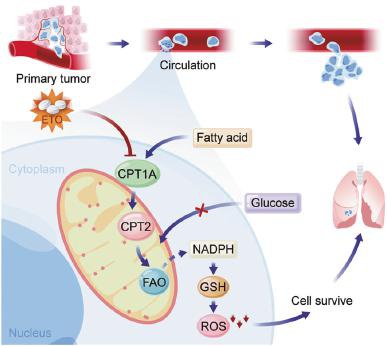
图4:总结:进入血液的CRC细胞,由于其CPT1A表达上调,FAO信号通路的激活,为转移的细胞提供了足够的还原力,使得细胞得以克服活性氧应激,最终能够在转移位点存活
研究意义:
该研究通过NuRNA™ Human Central Metabolism PCR Array筛选出非贴壁结直肠癌细胞中高表达的CPT1A,发现了CPT1A介导的脂肪酸氧化通路激活,通过维持氧化还原稳态,使CRC细胞免受失巢凋亡,促进存活。预示着在转移性的CRC患者中,靶向CPT1A将是一个在临床上有前景的应用
原文出处:
CPT1A-mediated fatty acid oxidation promotes colorectal cancer cell metastasis by inhibiting anoikis. Oncogene. 2018
-
科技前沿









