OpenSPR助力仿生递药系统研究
西南大学药学院李翀教授课题组致力于具有生物活性的功能性多肽设计、筛选及优化,围绕多肽介导药物靶向递送开展工作。继2018年10月在Nano Letters(IF:12.08)上发表经口服途径实现靶向抗真菌感染递送系统的高水平研究论文后(Nano Letters杂志快报---OpenSPR分子互作助力口服型肺炎纳米靶向药物研究),近日,李翀教授课题组在药物靶向递送领域又取得新突破,在国际知名刊物ACS Nano(IF:13.709)发表题为“Oriented Assembly of Cell-Mimicking Nanoparticles via a Molecular Affinity Strategy for Targeted Drug Delivery”的研究论文。该论文被选为ACS NANO五月份的封面论文。两项研究工作均使用Nicoya公司的OpenSPR获取多肽配体与目标分子亲和力的关键数据。
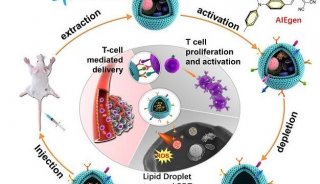
本次研究李翀教授课题组将目光转向了药物靶向递送的新兴领域-利用内源性细胞的细胞膜包被药物载体。这种新型的递送系统旨在赋予药物载体内源细胞膜的特殊功能并延长药物载体在体内的循环时间。在构建这种药物靶向递送系统时,研究人员面临着两个主要问题:内源性细胞膜能否有效包被纳米载体以及能否按照正确的方向包被。为了解决以上问题,李翀教授课题组提出了一种“分子亲和”策略,基于细胞膜上重要跨膜受体胞内区及其对应的多肽配体间的特异性相互作用,引导细胞膜高效、正确的包被药物载体。
鉴于病原真菌与宿主红细胞的相互作用,课题组选取了红细胞主要跨膜受体band 3作为“抓手”,首先设计出与band
3胞内区特异性结合的多肽配体,并使用OpenSPR确认了该多肽配体与band
3间的亲和力。除了亲和力的测定,研究人员还在OpenSPR上完成了竞争结合实验,进一步确认了多肽配体与band 3的有效结合。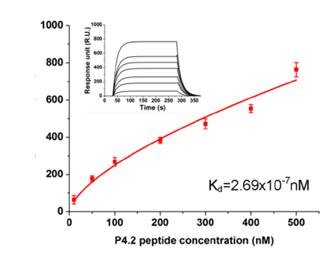
将多肽配体插入脂质体后,红细胞膜通过胞内band 3胞内区与脂质体表面多肽间相互作用包被脂质体。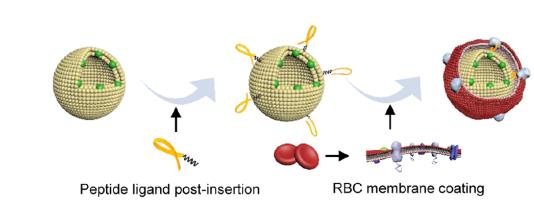
经实验验证,该脂质体有效继承了红细胞的免疫相容性以及体内长循环性能。与此同时,由于病原真菌捕获红细胞摄取铁离子的特性,该脂质体还可实现病原真菌的靶向药物递送。本研究通过“分子亲和”策略构建了红细胞膜包被的仿生脂质体,为内源性细胞膜包被药物递送系统的构建提供了新思路,并可拓展至各种生物膜相关纳米材料、纳米药物研究领域。
-
会议会展

-
会议会展

-
项目成果