苏长青:miRNA治疗癌症?也许不是全能,但充满希望
在百度上输入“肝癌”二字,除了一些百科性质的内容,常常还能看到“肝癌晚期能活多久”,“家人得了肝癌怎么办”,或者是“肝癌真的没得救了吗”之类的检索项。作为最常见的恶性肿瘤,原发性肝癌也许对于其它国家来说只是恶性肿瘤排行榜的一个名字,但是对于占据了全球一半新发肝癌病例的中国来说,这种疾病好似触手可及。
我国有数目庞大的慢性乙型肝炎患者,肝癌发病率居全球第一位,死亡率也十分高,香港音乐教父罗文,著名诗人汪国真,还有不少人熟悉的“肥肥”沈殿霞都是因为肝癌而去世的。这主要是由于手术切除目前是肝癌最有效的治疗手段,但前提需要尽早切除,越早,肿瘤越小,五年生存率越高。然而在国内,大部分患者一般在确诊时病程就已进入了中晚期,失去了手术治疗的机会,对于这部分患者,化疗和放疗也是临床常用的方法,不过肝癌的化疗和放疗疗效却不佳。
要想破冰,也许我们可以换个思路,另辟蹊径,“随着生命科学的发展,生物治疗成了第四种抗肿瘤治疗,可配合手术、化疗、放疗以减轻肿瘤对免疫的抑制,消灭残余癌细胞。在生物治疗的策略中,由于miRNAs表达谱的改变参与肿瘤发生、发展的整个过程,包括肿瘤细胞的起源、增殖、侵袭及转移,肿瘤细胞与其起源的相应正常组织细胞之间miRNAs表达谱存在差异,不同肿瘤之间miRNAs表达谱也有其特异性,因此,miRNAs已成为肿瘤靶向治疗的目标靶分子,”来自第二军医大学东方肝胆外科医院及国家肝癌科学中心的苏长青(Changqing Su)教授解释道。
上个月,苏教授研究组就针对癌症细胞内广泛表达的致癌性microRNAs,建立了一种能够同时干扰多种致癌性microRNAs功能,并影响多条癌症发生发展信号传导途径活性的肿瘤治疗新策略。
这一新策略不同于以往针对miRNA的治疗性研究,苏教授表示,过往方法大多针对单一miRNA,但由于miRNA作用的靶基因众多,调控机制复杂,因此对肿瘤的抑制效果很有限。那么这项最新的研究具体采用了什么样的策略?具有哪些优势?是否将能改变目前肝癌治疗的困境呢?为此生物通特联系了苏教授,进行独家专访,解密背后故事。
miRNA与癌症的相爱相杀
microRNA(miRNA)是一类22个核苷酸的调控转录本,它们与mRNA靶点相结合,或抑制其翻译,或诱导其降解。因此,它们也像转录因子一样,影响基因表达。细胞内发育成熟的miRNAs在多种生物的生命进程中起到关键作用,包括调节细胞早期发育、细胞增殖、干细胞分化和细胞凋亡等。
本世纪初,科学家们第一次发现microRNAs与癌症有关,当时来自耶鲁大学的发育生物学家Frank Slack与他的同事发现let-7 miRNA基因突变会导致细胞分裂增加。其后在2002年,另外一组研究人员又在他们的实验中发现慢性淋巴细胞性白血病样品中常见的基因缺失位于两个miRNA基因座(miR15 和 miR16)上。
时隔十多年,这一研究领域发展得更深入全面了,科学家们惊讶地发现miRNA与癌症发生发展之间的关联并不简单——它们相爱相杀,在一些肿瘤中,研究表明miRNA有时会过量表达,有时却会缺失。
苏教授解释说,随着研究的深入,人们发现,在乳腺癌、肝癌、肺癌、大肠癌、脑瘤、白血病等多种肿瘤中均发现特异性miRNAs的高表达,这些miRNAs能够灭活一些抑癌基因,主要赋予癌细胞不同的恶性生物学表征,因此可被视作是一类致癌性miRNAs(Oncogenic miRNAs,OncomiRs)。相对于正常细胞,肿瘤细胞中也有一些miRNAs表达下调甚至缺失,失去对相应癌基因的调控和监视作用,使这些癌基因表达升高,从而诱发或促进肿瘤的发展,这类miRNAs可视作抑癌性miRNAs(Oncosuppressor miRNAs)。
“这是一个十分有趣的双面作用,有的miRNAs在一些特定条件下是致癌性miRNAs,而在另外的条件下又是抑癌性miRNAs。同时,一个miRNA可以靶向多个靶基因,一个靶基因也可能受多种miRNAs的调控,因此一个miRNA分子的作用变化可能会引起难以判断的蝴蝶效应。
因此针对不同类型的miRNAs,需要设计不同的治疗策略。比如,癌细胞内低表达抑癌性miRNAs,可以通过转染miRNAs的方法提高其功能,发挥抑癌作用。癌细胞内高表达OncomiRs,则可以通过抑制OncomiRs表达和功能的方法,实现对肿瘤的治疗,”苏教授说。
控制住致癌性miRNA就万事大吉了?
正如上文所说,许多研究表明miRNA在很多肿瘤中被异常转录,因此对肿瘤细胞的异常增殖、抑制凋亡、快速侵袭等恶性特征起着非常重要的调节作用。由此一些学者就提出了“OncomiRs”的概念,比如研究人员曾发现在人肝癌细胞HCC中异常高表达的miR-21能降低抑癌基因PTEN蛋白表达水平,从而促进肝癌细胞增殖,转移和侵袭等。
那么将这种异常表达的OncomiRs恢复到正常表达水平,是否可以逆转肿瘤的恶性增殖,侵袭和转移,简而言之,治疗癌症呢?
目前的结论是:有可能。一些研究通过构建模型,以miRNA为肿瘤治疗靶标,确实可以通过诱导肿瘤细胞凋亡等途径,明显延缓肿瘤进展,但这只是第一步,而且还有一个重要的问题。
“近年来,以miRNAs为靶点的肿瘤治疗方案有很多,但现有的治疗性研究大多针对单一miRNA。由于miRNAs作用的靶基因众多,调控机制复杂,一个miRNA可以靶向多个靶基因,一个靶基因也可能受多种miRNAs的调控,miRNAs及其靶基因调控广泛的信号传导途径的活性。因此,单一miRNA表达的干预对肿瘤的抑制效果很有限,癌细胞很容易通过旁路信号传导途径重新获得增殖活力,”苏教授说。
正因为此,苏教授等人根据miRNAs的作用原理,设想在细胞内引入一条人工设计的干扰性长链非编码RNA(Interfering long non-coding RNA, LncRNAi),该LncRNAi同时包含能与多个OncomiRs种子序列互补结合的序列,就能够与OncomiRs的靶基因mRNAs竞争结合OncomiRs,从而消耗细胞内高水平的OncomiRs,实现对多种miRNAs的联合干预,对OncomiRs的抑癌性靶基因起保护作用。这样的竞争性保护作用,需要竞争者(即LncRNAi)的拷贝数要明显高于被竞争者(即靶基因mRNAs)才能显现良好的效果。
“LncRNAi与mRNAs的拷贝数比值越高,OncomiRs与靶基因mRNAs结合的效率就越低,靶基因的表达就会得到最大程度地保护。我们以肿瘤特异性增殖型腺病毒实现了LncRNAi的高拷贝高效率表达,从而使其竞争性作用处于优势水平。这样的治疗策略,以肝癌高表达的OncomiRs为靶点,可以同时有效封闭多个作用机制不同、或者作用机制互补的OncomiRs,广泛抑制OncomiRs相关的多条信号传导途径,为肿瘤治疗建立一种疗效可靠的技术平台。
这种策略的优势在于,克服了单一miRNA干预对肿瘤抑制效果有限、癌细胞很容易通过旁路信号途径重新获得增殖活力的缺陷;增殖型腺病毒在癌细胞内高效表达lncRNAi,其作用仅局限于癌细胞内表达含量高的OncomiRs,对癌细胞内本身含量就很低的抑癌性miRNAs不起作用;正常细胞因OncomiRs不表达或低表达而不受影响;lncRNAi编码序列前后插入终止密码子TAA,避免其翻译,保证了其生物安全性。”
总结来说,苏教授采用的新方法就是同时针对癌细胞内高表达的多个OncomiRs设计的治疗策略,其着眼点就是正常细胞因OncomiRs不表达而不受该治疗方法的影响。
真的有效吗?
看到这里,不少人会多问一句:真的有效吗?截止到2014年6月,miRBase数据库收录了223个物种的28645个miRNA前体,这些前体可表达35828个成熟的miRNAs分子。在这些miRNAs中,我们很难明确有多少数量的致癌性miRNAs或者抑癌性miRNAs,因为有的miRNAs在一些特定条件下是致癌性miRNAs,而在另外的条件下又是抑癌性miRNAs。我们要如何甄选?
此前,苏教授研究组已经在与肿瘤有关的miRNAs的调控和功能方面取得了许多成果(Cancer Lett 2014,344:147-156),在这些成果的基础上,他们结合文献检索,确定了12个肝癌细胞中高表达的OncomiRs,包括miR-21、miR-221/222、miR-224、miR-17-5p、miR-10b、miR-106b、 miR-151-5p、miR-155、miR-181a/181b、miR-184、miR-1、miR-501。
这些miRNA在肝癌的发生发展中作用机制不同或者作用效应互补,分别作用于不同的靶基因和信号传导途径,分别对肝癌细胞的增殖、侵袭、转移、凋亡发挥调控作用,甚至对乙肝病毒(HBV)的感染复制有促进作用,从而有助于HBV相关肝癌的癌变及进展。这些miRNAs的联合干预可能会抑制更为广泛的信号传导途径,对肿瘤的治疗更为有效。
“确切地说,这些miRNAs不但在肝癌特异性升高表达,而其中大多数也在多种肿瘤细胞中高表达,因此,只要适当调整其中几个miRNAs,该方法即可应用于其他肿瘤的治疗实验。对于一些确切与miRNAs异常有关的非肿瘤疾病的治疗,也有借鉴意义。”
苏教授将他的这种策略称为竞争性消耗OncomiRs的抗癌新策略,这种策略克服了针对单一miRNA治疗的缺陷,不仅可用于肝癌的治疗,也可为其他肿瘤乃至其它疾病的治疗提供借鉴,具有良好的应用前景和开发价值。该治疗策略同时申请了国家发明专利和国际PCT专利保护。
更多的实验验证
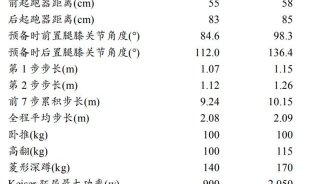
同时,在这篇发表论文中,苏教授为了验证竞争性消耗OncomiRs这种干预治疗策略,进行了多项实验验证,如在肝癌细胞系HepG2、Hep3B、SMMC-7721、MHCC97H、MHCC97L、Huh-7、PLC/PRF/5、BEL-7402中,结果显示,该策略对Hep3B和Huh-7杀伤活性最强,Hep3B存活率在病毒感染强度(MOI)=0.5pfu/cell时已下降到50%以下,在MOI=2pfu/cell时已下降到10%以下;Huh-7存活率在MOI=1pfu/cell时已下降到50%以下,在MOI=100pfu/cell时已下降到10%以下。
对HepG2、MHCC97L、PLC/PRF/5、MHCC97H、SMMC-7721的杀伤也较强,在MOI=100pfu/cell时存活率都下降到50%以下。对BEL-7402的杀伤活性较弱,在MOI=200pfu/cell时存活率才下降到50%以下。AdSVPE1a-lncR对正常肝细胞生物增殖无明显影响,在MOI=500时细胞存活率仍维持在80%以上。
“动物模型方面,我们构建了2个肝癌细胞系Huh-7和HepG2的移植瘤模型,以及来源于5个肝癌患者的patient-derived xenograft (PDX)模型,所有模型均证明该治疗策略具有非常好的肿瘤抑制作用(见下)”,苏教授补充道。
miRNA治疗癌症也许不是全能,但充满希望
“肿瘤被认为是一种慢性病,需要综合治疗,治疗的目的以延长生存期、提高带瘤生活质量为主要方向,这种观念越来越被人们接受。目前,针对PD-1/PD-L1和CAR-T的免疫靶向治疗取得了飞快的发展,而其他治疗措施也层出不穷。但任何一种治疗方法都不是全能的,需要我们针对不同疾病、不同条件、不同类型等,设计出更多可供选择的治疗策略。
我们的针对miRNAs的联合干预策略,只要稍加变通,即可适用于多种肿瘤的治疗,也可应用于其他与miRNAs异常有关的非肿瘤疾病。我们对该项治疗策略已申报PCT专利保护,经国际专利局查询,证实该策略具有的创造性、新颖性和实用性无容置疑。在这一领域,我们将继续深入研究下去,争取尽早实现转化应用”,苏教授总结道。
作者简介:
苏长青
第二军医大学东方肝胆外科医院及国家肝癌科学中心分子肿瘤研究室主任、教授、博士、博士研究生导师、上海市优秀学术带头人。《Cancer Letters》、《临床肿瘤学杂志》、《诊断学理论与实践》和《中国药理学通报》杂志编委,国际《J Hepatol》、《MolOncol》等30余家SCI期刊审稿人,中国抗癌协会胆道肿瘤专业委员会委员,国家自然科学基金委员会和上海市科学技术委员会专家库成员,中欧生物医药委员会国际创新药物研发联盟中欧专家学术委员会执行理事,首届国家科学技术进步奖创新团队成员(第二军医大学肝癌临床与基础集成化研究创新团队)。
领衔的课题组致力于肿瘤细胞周期调控与生物靶向治疗、肿瘤复发转移的机制及干预研究、抗肿瘤创新药物研发,先后承担国家科技重大专项课题重大新药创制项目、国家自然科学基金项目等研究课题20项,在Gut、MolOncol、Mol Cancer Ther、Cancer Res、Oncotarget、MolTher、Cancer Lett、Mol Cancer Res、TumourBiol等肿瘤学杂志发表SCI论文60余篇。曾获得国家科学技术进步奖创新团队奖、国家教育部高校科研优秀成果二等奖、军队医疗成果一等奖、上海市科技进步奖二等奖、全军科技进步奖二等奖、南京军区后勤重大科技成果奖一等奖等奖项20余项。
-
企业风采

-
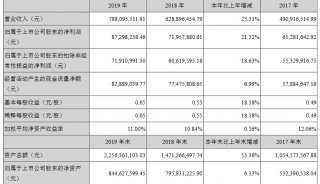
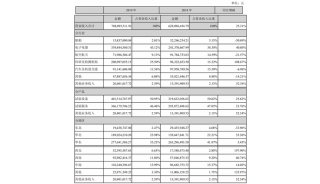
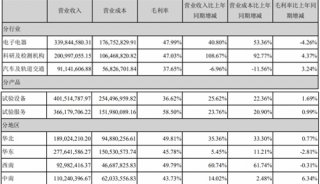
财报

-
焦点事件

-
焦点事件

-
精英视角

-
企业风采